
醫用氯化鈣可用于補鈣、抗過敏和消炎等,以工業碳酸鈣(含少量Na+、Al3+、Fe3+等雜質)生產醫用二水合氯化鈣工藝流程為:
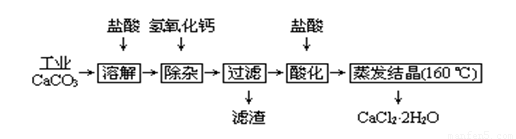
已知:查閱資料得知氫氧化物沉淀時的pH為:
|
氫氧化物 |
Fe(OH)3 |
Al(OH)3 |
|
|
開始沉淀時的pH |
2.3 |
4.0 |
開始溶解:7.8 |
|
完全沉淀時的pH |
3.7 |
5.2 |
完全溶解:10.8 |
(1)CaCO3與鹽酸反應的離子方程式 。
(2)除雜操作是加入氫氧化鈣,調節溶液的pH為 ,目的是除去溶液中少量的Al3+、Fe3+。檢驗Fe(OH)3是否沉淀完全的實驗操作是
。
(3)過濾時需用的玻璃儀器有 。濾渣主要成分的化學式 。
(4)酸化時加鹽酸的目的為:① ,②防止Ca2+ 在蒸發時發生水解。
(5)為什么蒸發結晶要保持在160℃: 。
(6)測定晶體樣品的純度:若用一定濃度的AgNO3溶液滴定一定質量的晶體樣品,所測樣品中CaCl2 ·2H2O的質量分數偏高(忽略其它實驗誤差),可能的原因之一為 。
(16分,每空2分)
(1)CaCO3+2H+=Ca2++CO2↑+H2O
(2)5.2~7.8(或之間的任意值、5.2≤pH<7.8) 靜置,取少量上層清液于小試管中,滴加KSCN溶液,若不顯紅色,則Fe(OH)3沉淀完全;反之,則Fe(OH)3沉淀不完全
(3) 燒杯、玻璃棒、普通漏斗 Fe(OH)3 、Al(OH)3
(4)除去過量的氫氧化鈣(或防止氫氧化鈣吸收空氣中的二氧化碳,防止鈣離子水解等,合理則給分)
(5)溫度太高CaCl2 ·2H2O會失水
(6) Na+沒除去析出NaCl,導致測定結果偏高(或少量CaCl2 ·2H2O失水)
【解析】
試題分析:(1)鹽酸是強酸,酸性比碳酸強,則難溶于水的碳酸鈣易溶于鹽酸,生成可溶性的氯化鈣、二氧化碳氣體和水,將易溶且易電離的化合物改寫成離子形式,其余物質都保留化學式,刪去實際上未反應的離子,則該反應為CaCO3+2H+=Ca2++CO2↑+H2O;(2)根據表中氫氧化物完全沉淀時的pH可知,除去溶液中少量鐵離子和鋁離子應使溶液pH介于5.2~7.8之間或者5.2≤pH<7.8,低于3.7時鐵離子不能完全變為氫氧化鐵沉淀,低于5.2時鋁離子不能完全變為氫氧化鋁沉淀,高于7.8時,氫氧化鋁開始變為偏鋁酸根離子,溶液又引入新的雜質;檢驗氫氧化鐵是否沉淀的方法就是檢驗溶液中是否存在鐵離子,由于鐵離子遇KSCN溶液變紅的特征反應,通常設計的實驗方案為:靜置,取少量上層清液于小試管中,滴加KSCN溶液,若不顯紅色,則Fe(OH)3沉淀完全,反之,則Fe(OH)3沉淀不完全;(3)過濾屬于化學實驗基本操作,也是混合物分離與提純的常用方法,主要使用燒杯、玻璃棒、普通漏斗等儀器;當溶液pH介于5.2~7.8之間時,鐵離子、鋁離子完全變為氫氧化鐵沉淀、氫氧化鋁沉淀,則過濾所得濾渣的成分為Fe(OH)3、Al(OH)3;(4)氫氧化鈣是除雜試劑,除雜試劑一定過量,氫氧化鈣是強堿,由于目標產物是氯化鈣,則酸化時加入鹽酸的目的是除去過量的氫氧化鈣,將其轉化為氯化鈣,防止氫氧化鈣吸收空氣中的二氧化碳,且過量的鹽酸受熱易揮發逸出(逸出的氯化氫氣體可循環利用),不能加硝酸或硫酸酸化,因為它們除去舊雜質時會引入硝酸根離子或硫酸根離子等新雜質;(5)結晶水化合物受熱可能失去結晶水,蒸發結晶要控制溫度在160℃的原因是,溫度太高,二水合氯化鈣會失去結晶水;(6)滴定原理為:Ag++Cl-=AgCl↓,若氯離子的物質的量偏大,則測定結果偏高;酸化后所得溶液主要含有氯化鈣、氯化鈉、氯化氫,蒸發結晶時逸出氯化氫,但是沒有除去鈉離子,則所得晶體是二水合氯化鈣和氯化鈉的混合物,氯元素的質量分數:CaCl2>NaCl> CaCl2•H2O >CaCl2•2H2O,因此晶體樣品中含有NaCl或二水合氯化鈣失去全部或部分結晶水得到的CaCl2或CaCl2•H2O,都能導致所含氯元素的質量分數偏高,則所測樣品二水合氯化鈣的質量分數偏高。
考點:考查有關物質制備的化學工藝流程推斷題,涉及主要流程中離子方程式、控制溶液pH除去雜質金屬陽離子、檢驗鐵離子是否沉淀完全的方案、過濾所用儀器、濾渣成分、酸化的目的、控制溫度的原因、樣品純度測定結果偏高的原因等。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
(14分)醫用氯化鈣可用于補鈣抗過敏等,以工業碳酸鈣(含少量Na+、Al3+、Fe3+等雜質)生產醫用二水合氯化鈣(CaCl2 ·2H2O的質量分數為97.3—103.0%),工藝流程為:
(1)CaCO3與鹽酸反應的離子方程式 。
(2)過濾時需用的玻璃儀器除燒杯、玻璃棒外還有 。濾渣主要成分的化學式 。
(3)酸化時加鹽酸的目的為:
① ,
②防止Ca2+ 在蒸發時發生水解。
(4)為什么蒸發結晶要保持在160℃: 。
(5)為測定樣品中CaCl2 ·2H2O的含量,稱取0.7522g樣品并配成250mL溶液,分別取該溶液25.00mL于三個錐形瓶中,用0.04mol/LAgNO3溶液進行三次滴定,消耗 AgNO3溶液的平均體積為20.39mL。
①通過計算,樣品中含CaCl2 ·2H2O的質量分數 。
②若所測樣品 CaCl2 ·2H2O的質量分數偏高(忽略其它實驗誤差),可能的原因之一為 。
查看答案和解析>>
科目:高中化學 來源:2011—2012學年廣東省羅定中學高三理綜周測化學試卷 題型:實驗題
(16分)醫用氯化鈣可用于補鈣抗過敏等,以工業碳酸鈣(含少量Na+、Al3+、Fe3+等雜質)生產醫用二水合氯化鈣(CaCl2 ·2H2O的質量分數為97.3—103.0%),工藝流程為:
(可能用到的原子量:Cl 35.5 Ca 40 O 16 )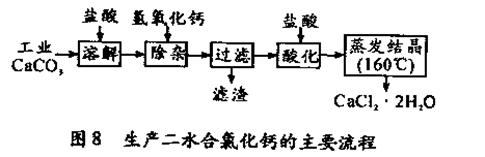
(1)CaCO3與鹽酸反應的離子方程式 。
(2)過濾時需用的玻璃儀器除燒杯、玻璃棒外還有 。濾渣主要成分的化學式 。
(3)酸化時加鹽酸的目的為:
① ,
②防止Ca2+ 在蒸發時發生水解。
(4)為什么蒸發結晶要保持在160℃:  。
。
(5)為測定樣品中CaCl2 ·2H2O的含量,稱取0.7522g樣品并配成250mL溶液,分別取該溶液25.00mL于三個錐形瓶中,用0.04mol/LAgNO3溶液進行三次滴定,消耗 AgNO3溶液的平均體積為20.39mL。
①通過計算,樣品中含CaCl2 ·2H2O的質量分數 。(只寫計算式不計算結果)。
②若所測樣品 CaCl2 ·2H2O的質量分數偏高(忽略其它實驗誤差),可能的原因之一為  。
。
查看答案和解析>>
科目:高中化學 來源:2012屆浙江省臨海市白云中學高三上學期第一次月考化學試題卷 題型:實驗題
(14分)醫用氯化鈣 可用于補鈣抗過敏等,以工業碳酸鈣(含少量Na+、Al3+、Fe3+等雜質)生產醫用二水合氯化鈣(CaCl2 ·2H2O的質量分數為97.3—103.0%),工藝流程為:
可用于補鈣抗過敏等,以工業碳酸鈣(含少量Na+、Al3+、Fe3+等雜質)生產醫用二水合氯化鈣(CaCl2 ·2H2O的質量分數為97.3—103.0%),工藝流程為: 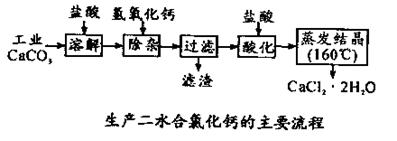
(1)CaCO3與鹽酸反應的離子方程式 。
(2)過濾時需用的玻璃儀器除燒杯、玻璃棒外還有 。濾渣主要成分的化學式 。
(3)酸化時加鹽酸的目的為:
① ,
②防止Ca2+ 在蒸發時發生水解。
(4)為什么蒸發 結晶要保持在160℃: 。
結晶要保持在160℃: 。
(5)為測定樣品中CaCl2 ·2H2O的含量,稱取0.7522g樣品并配成250mL溶液,分別取該溶液25.00mL于三個錐形瓶中,用0.04mol/LAgNO3溶液進行三次滴定,消耗 AgNO3溶液的平均體積為20.39mL。
①通過計算,樣品中含CaCl2 ·2H2O的質量分數 。
②若所測樣品 CaCl2 ·2H2O的質量分數偏高(忽略其它實驗誤差),可能的原因之一為 。
。
查看答案和解析>>
科目:高中化學 來源:2011-2012學年浙江省臨海市高三上學期第一次月考化學試題卷 題型:實驗題
(14分)醫用氯化鈣可用于補鈣抗過敏等,以工業碳酸鈣(含少量Na+、Al3+、Fe3+等雜質)生產醫用二水合氯化鈣(CaCl2 ·2H2O的質量分數為97.3—103.0%),工藝流程為:
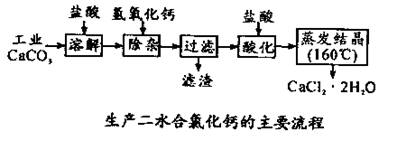
(1)CaCO3與鹽酸反應的離子方程式 。
(2)過濾時需用的玻璃儀器除燒杯、玻璃棒外還有 。濾渣主要成分的化學式 。
(3)酸化時加鹽酸的目的為:
① ,
②防止Ca2+ 在蒸發時發生水解。
(4)為什么蒸發結晶要保持在160℃: 。
(5)為測定樣品中CaCl2 ·2H2O的含量,稱取0.7522g樣品并配成250mL溶液,分別取該溶液25.00mL于三個錐形瓶中,用0.04mol/LAgNO3溶液進行三次滴定,消耗 AgNO3溶液的平均體積為20.39mL。
①通過計算,樣品中含CaCl2 ·2H2O的質量分數 。
②若所測樣品 CaCl2 ·2H2O的質量分數偏高(忽略其它實驗誤差),可能的原因之一為 。
查看答案和解析>>
科目:高中化學 來源:2012屆廣東省高三理綜周測化學試卷 題型:實驗題
(16分)醫用氯化鈣可用于補鈣抗過敏等,以工業碳酸鈣(含少量Na+、Al3+、Fe3+等雜質)生產醫用二水合氯化鈣(CaCl2 ·2H2O的質量分數為97.3—103.0%),工藝流程為:
(可能用到的原子量:Cl 35.5 Ca 40 O 16 )
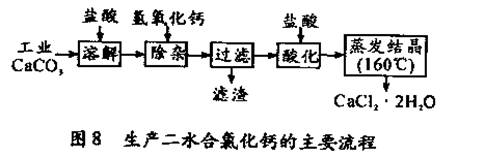
(1)CaCO3與鹽酸反應的離子方程式 。
(2)過濾時需用的玻璃儀器除燒杯、玻璃棒外還有 。濾渣主要成分的化學式 。
(3)酸化時加鹽酸的目的為:
① ,
②防止Ca2+ 在蒸發時發生水解。
(4)為什么蒸發結晶要保持在160℃: 。
(5)為測定樣品中CaCl2 ·2H2O的含量,稱取0.7522g樣品并配成250mL溶液,分別取該溶液25.00mL于三個錐形瓶中,用0.04mol/LAgNO3溶液進行三次滴定,消耗 AgNO3溶液的平均體積為20.39mL。
①通過計算,樣品中含CaCl2 ·2H2O的質量分數 。(只寫計算式不計算結果)。
②若所測樣品 CaCl2 ·2H2O的質量分數偏高(忽略其它實驗誤差),可能的原因之一為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com