
| A. | 加入少量NaOH固體后溶液pH小于9 | |
| B. | 加水稀釋,CH3COONa水解程度增大,c(OH-)增大 | |
| C. | 該溶液水電離出的c(OH-)═10-9 | |
| D. | CH3COOH在常溫下Ka數值約為1×10-5 |
分析 A、加入NaOH固體后c(OH-)增大;
B、鹽溶液越稀越水解;
C、在鹽溶液中,氫氧根和氫離子全部來自于水的電離;
D、醋酸平衡常數Ka需要根據醋酸鈉的水解平衡常數計算.
解答 解:A、加入NaOH固體后c(OH-)增大,則pH變大,即大于9,故A錯誤;
B、鹽溶液越稀越水解,故加水稀釋,CH3COONa水解程度增大,但由于溶液體積增大,故c(OH-)減小,故B錯誤;
C、在鹽溶液中,氫氧根和氫離子全部來自于水的電離,但由于CH3COO-將水電離出的氫離子結合,故溶液中的氫氧根是水電離出的全部,而pH=9時,溶液中的c(OH-)═10-5,即水電離出的c(OH-)═10-5,故C錯誤;
D、醋酸平衡常數Ka需要水解平衡常數計算,CH3COO-+H2O?CH3COOH+OH-,Kh=$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$=$\frac{c(C{H}_{3}COOH)•{K}_{w}}{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}$=$\frac{{K}_{w}}{{K}_{a}}$=$\frac{1{0}^{-5}×1{0}^{-5}}{0.1}$,故解得Ka=10-5,故D正確;故選D.
點評 本題考查了鹽類水解的分析判斷,弱電解質電離平衡常數的計算應用和影響水解平衡的因素分析,掌握基礎是關鍵,題目難度中等.


 寒假天地重慶出版社系列答案
寒假天地重慶出版社系列答案科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 2Ag(NH3)2+(aq)+2OH-(aq)△H=(2a-b)kJ?mol-1;
2Ag(NH3)2+(aq)+2OH-(aq)△H=(2a-b)kJ?mol-1;查看答案和解析>>
科目:高中化學 來源: 題型:解答題
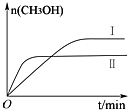 研究CO2的利用對促進低碳社會的構建具有重要的意義.
研究CO2的利用對促進低碳社會的構建具有重要的意義.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在pH=1的無色溶液中:SO42-、Cu2+、Na+、Cl- | |
| B. | 常溫下由水電離出的c(H+)=1×10-12mol/L的溶液中:K+、Na+、Cl-、HCO3- | |
| C. | 有Fe3+存在的溶液中:CO32-、NH4+、SO42-、Cl- | |
| D. | 在能使石蕊試紙變藍色的溶液中:Na+、K+、S2-、CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 22.4 L H2 | B. | 含3.01×1023 個分子的Cl2 | ||
| C. | 10g NH3 | D. | 0.8 mol SO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 .下列說法不正確的是( )
.下列說法不正確的是( )| A. | 上述反應屬于取代反應 | |
| B. | 對三聯苯分子中至少有16個原子共平面 | |
| C. | 對三聯苯的一氯取代物有5種 | |
| D. | 1mol對三聯苯在足量的氧氣中完全燃燒消耗21.5molO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | CuSO4 | B. | CH3CH2OH | C. | Na2SO4 | D. | NH4CI |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com