
 ,F元素周期表的位置:第三周期第ⅦA族,C2B2的電子式為:
,F元素周期表的位置:第三周期第ⅦA族,C2B2的電子式為: .AB2的結構式為:O=C=O.該化合物是由極性(填“極性”、“非極性”)鍵形成的.
.AB2的結構式為:O=C=O.該化合物是由極性(填“極性”、“非極性”)鍵形成的.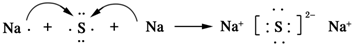 .該化合物屬于離子(填“共價”或“離子”)化合物.
.該化合物屬于離子(填“共價”或“離子”)化合物.分析 C元素的原子半徑是短周期主族元素中最大的,則C為Na元素;D元素是地殼中含量最高的金屬元素,則D為Al元素;E的最外層電子數是其電子層數的2倍,最外層電子數不超過8個,E處于第三周期,則E最外層電子數是6,為S元素,F的原子序數大于S元素,則F為Cl元素;A的最高價氧化物水化物為H2AO3,則A的最高價為+4價,原子序數小于Na,則A為C元素;B、E同族,則B為O元素,據此結合元素周期律知識進行解答.
解答 解:C元素的原子半徑是短周期主族元素中最大的,則C為Na元素;D元素是地殼中含量最高的金屬元素,則D為Al元素;E的最外層電子數是其電子層數的2倍,最外層電子數不超過8個,E處于第三周期,則E最外層電子數是6,為S元素,F的原子序數大于S元素,則F為Cl元素;A的最高價氧化物水化物為H2AO3,則A的最高價為+4價,原子序數小于Na,則A為C元素;B、E同族,則B為O元素,
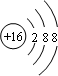
(1)A的元素符號為C;E為S元素,硫離子核外電子總數為18,其離子的結構示意圖為: ;F為Cl元素,其原子序數為17,處于元素周期表中第三周期第ⅦA族;C2B2為Na2O2,過氧化鈉屬于離子化合物,其電子式為:
;F為Cl元素,其原子序數為17,處于元素周期表中第三周期第ⅦA族;C2B2為Na2O2,過氧化鈉屬于離子化合物,其電子式為: ;AB2為CO2,二氧化碳分子中含有兩個碳氧雙鍵,其結構簡式為:O=C=O;二氧化碳分子中存在的C-O鍵為極性鍵,
;AB2為CO2,二氧化碳分子中含有兩個碳氧雙鍵,其結構簡式為:O=C=O;二氧化碳分子中存在的C-O鍵為極性鍵,
故答案為:C; ;第三周期第ⅦA族;
;第三周期第ⅦA族; ;O=C=O;極性;
;O=C=O;極性;
(2)離子的電子層越多,離子半徑越大,電子層相同時,離子的核電荷數越大,離子半徑越小,據此可知四種離子的離子半徑大小為:Cl->O2->Na+>Al3+,
故答案為:Cl->O2->Na+>Al3+;
(3)E、F分別為S、Cl元素,二者處于同一周期,原子序數越大,非金屬性越強,則非金屬性較強的為Cl元素;
①常溫下E的單質呈固態,F的單質呈氣態:物質的存在狀態與非金屬性強弱無關,故①錯誤;
②非金屬元素的氣態氫化物越穩定,非金屬性越強,氣態氫化物的穩定性:F>E,則非金屬性:Cl>S,故②正確;
③E和F形成的化合物中,E顯正價,說明F的得電子能力更強,則非金屬性Cl>S,故③正確;
④F單質能與E的氫化物發生置換反應,說明氯氣的氧化性大于S,則非金屬性:Cl>S,故④正確;
⑤E和F的氧化物的水化物的酸性強弱:必須是最高價氧化物對應的水化物,沒有證明最高價氧化物,故⑤錯誤;
⑥氣態氫化物的還原性:E>F,則對應元素的氧化性恰好相反,即非金屬性:Cl>S,故⑥正確;
故答案為:Cl;②③④⑥;
(4)C2E為Na2S,硫化鈉屬于離子化合物,用電子式表示其形成過程為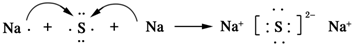 ,
,
故答案為: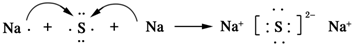 ;離子;
;離子;
(5)C、D的最高價氧化物對應水化物分別為NaOH、氫氧化鋁,二者發生反應生成偏鋁酸鈉和水,反應的離子方程式為Al(OH)3+OH-═AlO2-+2H2O,
故答案為:Al(OH)3+OH-═AlO2-+2H2O.
點評 本題考查了位置、結構與性質關系的綜合應用,題目難度中等,試題知識點較多、綜合性較強,充分考查學生的分析、理解能力及靈活應用基礎知識的能力,注意熟練掌握原子結構與元素周期表、元素周期律的關系.


 互動英語系列答案
互動英語系列答案 名牌學校分層周周測系列答案
名牌學校分層周周測系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

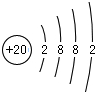 ,寫出氣體甲的電子式
,寫出氣體甲的電子式 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1 mol•L-1 NH4Cl溶液:c(NH4+)<c( Cl-) | |
| B. | 向醋酸鈉溶液中加入適量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 0.1 mol•L-1 Na2CO3溶液:c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3) | |
| D. | NaHCO3溶液中:c(H+)+c(Na+)=c(OH-)+2c(CO32-)+c(HCO3-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
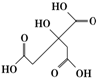 物質X的結構式如圖所示,常被用于香料或作為飲料的酸化劑,在食品和醫學上用作多價螯合劑,也是化學中間體.下列關于物質X的說法正確的是( )
物質X的結構式如圖所示,常被用于香料或作為飲料的酸化劑,在食品和醫學上用作多價螯合劑,也是化學中間體.下列關于物質X的說法正確的是( )| A. | X分子式為C6H7O7 | |
| B. | 1 mol物質X可以和4mol氫氧化鈉發生反應 | |
| C. | X分子內所有原子均在同一平面內 | |
| D. | 足量的X分別與等物質的量的NaHCO3、Na2CO3反應得到的氣體物質的量相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2A(l)+B(l)=2C(g)△H1=-Q1 | B. | 2A(g)+B(g)=2C(g)△H2=-Q2 | ||
| C. | 2A(g)+B(g)=2C(l)△H3=-Q3 | D. | 2A(l)+B(l)=2C(l)△H4=-Q4 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ⑥ | ⑦ | ⑪ | |||||
| 三 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 四 | ② | ④ | ⑨ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子間通過共用電子形成的化學鍵叫共價鍵 | |
| B. | 對雙原子分子來說,鍵能越大,斷開時需要的能量越多,該化學鍵越不牢固 | |
| C. | 一般而言,化學鍵的鍵長越短,鍵越牢固,分子越穩定 | |
| D. | 成鍵原子間原子軌道重疊得越多,共價鍵越牢固 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com