
分析 (1)在水溶液或者熔融狀態能夠導電的化合物為電解質,電解質必須是化合物;
(2)H++OH-═H2O,表示可溶性強酸或者強酸的酸式鹽與可溶性強堿反應生成可溶性鹽和水;
(3)硫酸鋁為強電解質,電離生成鋁離子和硫酸根離子;根據公式N=nNA=$\frac{m}{M}$NA以及c=$\frac{n}{V}$來計算解答;
(4)少量的二氧化碳可以和強堿反應生成碳酸鹽和水;
(5)氫氧化鋇與硫酸氫鈉按照物質的量之比1:1反應,硫酸根離子恰好沉淀完全.
解答 解:(1)①H2 是單質不是電解質;
②鋁是單質不是電解質;
③CaO熔融狀態下能導電,屬于電解質;
④CO2 本身不能電離產生自由移動離子,是非電解質;
⑤NaHSO4 在水溶液或者熔融狀態能夠導電的化合物為電解質;
⑥Ba(OH)2在水溶液或者熔融狀態能夠導電的化合物為電解質;
⑦氫氧化鐵膠體是混合物,不是電解質;
⑧氨水 是混合物,不是電解質;
⑨稀硝酸是混合物,不是電解質;
酸⑩Al2(SO4)3在水溶液或者熔融狀態能夠導電的化合物為電解質;
所以屬于電解質的是③⑤⑥⑩;
故答案為:③⑤⑥⑩;
(2)H++OH-═H2O,表示可溶性強酸或者強酸的酸式鹽與可溶性強堿反應生成可溶性鹽和水,可以表示氫氧化鋇與硝酸的反應,方程式:Ba(OH)2+2HNO3═Ba(NO3)2+2H2O;
故答案為:Ba(OH)2+2HNO3═Ba(NO3)2+2H2O;
(3)硫酸鋁是強電解質,能完全電離,電離方程式為:Al2(SO4)3=2Al3++3SO42-,17.1gAl2(SO4)3溶于水配成250mL溶液,SO42-的粒子數為$\frac{17.1g}{342g/mol}$=9.03×1022,SO42-的物質的量濃度c=$\frac{n}{V}$=0.6mol/L,鋁離子物質的量濃度為:$\frac{2}{3}$×0.6mol/L=0.4mol/L;
故答案為:9.03×1022,0.4mol/L;
(4)少量的二氧化碳可以和強堿氫氧化鋇反應生成碳酸鋇和水,即Ba(OH)2+CO2=BaCO3↓+H2O,
故答案為:Ba(OH)2+CO2=BaCO3↓+H2O;
(5)氫氧化鋇與硫酸氫鈉按照物質的量之比1:1反應,硫酸根離子恰好沉淀完全,離子方程式:H++SO42-+Ba2++OH-═BaSO4↓+H2O;
故答案為:H++SO42-+Ba2++OH-═BaSO4↓+H2O.
點評 本題考查了電解質判斷,物質的量有關計算,離子方程式書寫,明確電解質概念,熟悉以物質的量為核心計算公式是解題關鍵,側重考查學生分析和解決問題的能力,難度不大.


 字詞句篇與同步作文達標系列答案
字詞句篇與同步作文達標系列答案 走進文言文系列答案
走進文言文系列答案科目:高中化學 來源: 題型:選擇題
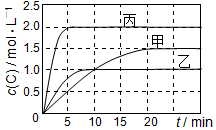 向甲、乙、丙三個密閉容器中充入一定量的A和B,發生反應:A(g)+xB(g)?2C(g).各容器的反應溫度、反應物起始量,反應過程中C的濃度隨時間變化關系分別以如表和如圖表示:
向甲、乙、丙三個密閉容器中充入一定量的A和B,發生反應:A(g)+xB(g)?2C(g).各容器的反應溫度、反應物起始量,反應過程中C的濃度隨時間變化關系分別以如表和如圖表示:| 容器 | 甲 | 乙 | 丙 |
| 容積 | 0.5 L | 0.5 L | 1.0 L |
| 溫度/℃ | T1 | T2 | T2 |
| 反應物 起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
| A. | 平衡后,向甲容器中再充入0.5 mol A,A和B的轉化率均增大 | |
| B. | 達到平衡時反應吸收的熱量:Q丙>2Q乙 | |
| C. | 若平衡時保持溫度不變,改變容器體積平衡不移動 | |
| D. | T1℃,起始時甲容器中充入0.5 mol A、1.5 mol B,平衡時A的轉化率為25% |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 增大反應物的濃度,可增大單位體積內活化分子的百分數,從而使有效碰撞次數增大 | |
| B. | 有氣體參加的化學反應,若增大壓強(即縮小反應容器的體積),可增加活化分子的百分數,從而使反應速率增大 | |
| C. | 升高溫度能使化學反應速率增大,主要原因是增加了反應物分子中活化分子的百分數 | |
| D. | 催化劑雖然不參加化學反應,但能增大單位體積內活化分子的數目,從而增大反應速率 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 某溶液中滴加AgNO3溶液有白色沉淀,說明原溶液中有Cl- | |
| B. | 某溶液中先滴足量鹽酸無現象,再滴加BaCl2溶液有白色沉淀,說明原溶液中有SO42- | |
| C. | 某溶液中滴加NaOH溶液有藍色沉淀,說明原溶液中有Fe3+ | |
| D. | 某溶液中滴加稀硫酸生成無色氣體,說明原溶液中有CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 CO2是一種溫室氣體,據科學家預測,到21世紀中葉,全球氣溫將升高1.5-4.5℃,地球氣溫的升高會引起海平面升高,對人類的生存環境產生巨大的影響.如何合理地利用CO2是擺在科學家面前的一個重大課題.回答下列問題:
CO2是一種溫室氣體,據科學家預測,到21世紀中葉,全球氣溫將升高1.5-4.5℃,地球氣溫的升高會引起海平面升高,對人類的生存環境產生巨大的影響.如何合理地利用CO2是擺在科學家面前的一個重大課題.回答下列問題:| CO2的量 | NaOH溶液的量 | 放出的熱量 | |
| ① | 22.0g | 750mL1.0mol•L-1 | xkJ |
| ② | 1.0mol | 2.0mL1.0mol•L-1 | ykJ |
| 物質 | CO2(g) | H2(g) | CH4(g) | H2O(g) |
| 濃度/mol•L-1 | 0.2 | 0.8 | a | 1.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 鎳具有優良的物理和化學特性,是許多領域尤其是高技術產業的重要原料.羰基法提純粗鎳涉及的兩步反應依次為:
鎳具有優良的物理和化學特性,是許多領域尤其是高技術產業的重要原料.羰基法提純粗鎳涉及的兩步反應依次為:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 濃硫酸稀釋時應注意將濃硫酸緩緩地倒入盛有水的容量瓶中 | |
| B. | 將11.2L HCl溶于水形成1L溶液,所得溶液的物質的量濃度為0.5mol/L | |
| C. | 0.5mol/L的Na2SO4和1mol/L的NaOH溶液,c(Na+)相同 | |
| D. | 將20g NaOH 溶于1L水中即得到0.5mol/L的NaOH溶液 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com