
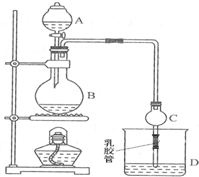
 已知:①無水氯化鈣可與乙醇形成難溶于水的CaCl2•6C2H5OH.
已知:①無水氯化鈣可與乙醇形成難溶于水的CaCl2•6C2H5OH.| 試劑 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸點/℃ | 34.7 | 78.5 | 118 | 77.1 |
 CH3COOCH2CH3+H218O.
CH3COOCH2CH3+H218O.分析 (1)乙酸與乙醇在濃硫酸作催化劑、加熱的條件下發生酯化反應生成乙酸乙酯,該反應為可逆反應,濃硫酸吸水利于平衡向生成乙酸乙酯方向移動;反應中通常加入過量的乙醇,提高乙酸的轉化率;
(2)酯化反應的本質為酸脫羥基,醇脫氫,乙醇、乙酸反應生成乙酸乙酯和水,且為可逆反應;
(3)儀器A的名稱是分液漏斗,圓底燒瓶受熱不均,球形干燥管的管口伸入液面下可能發生倒吸,同時起冷凝作用;醇與乙酸都易揮發,D中的溶液為飽和的碳酸鈉溶液,碳酸根水解,溶液呈堿性,制備的乙酸乙酯含有乙醇與乙酸,用飽和碳酸鈉溶液吸收乙酸乙酯,反應掉揮發出來的乙酸,使之轉化為乙酸鈉溶于水中,便于聞乙酸乙酯的香味,溶解揮發出來的乙醇,降低乙酸乙酯在水中的溶解度,便于分層得到酯,故反應后溶液分層,上層無色油體液體,下層溶液顏色變淺;
(4)用氯化鈣除去少量乙醇,用無水硫酸鈉除去少量的水,然后進行蒸餾,收集77℃左右的餾分,以得到較純凈的乙酸乙酯.
解答 解:(1)酸與乙醇需濃硫酸作催化劑,該反應為可逆反應,濃硫酸吸水利于平衡向生成乙酸乙酯方向移動,由于反應加入的是乙酸鈉,故濃硫酸還制乙酸的作用,故濃硫酸的作用是酸性、催化劑、吸水劑,乙醇相對廉價,加入過量的乙醇,增大反應物濃度,使平衡向正反應方向移動,提高乙酸的轉化率,
故答案為:吸水劑、催化劑、制乙酸;提高乙酸的轉化率;
(2)酯化反應的本質為酸脫羥基,醇脫氫,乙酸與乙醇在濃硫酸作用下加熱發生酯化反應生成乙酸乙酯和水,該反應方程式為:CH3CO18OH+CH3CH2OH  CH3COOCH2CH3+H218O,
CH3COOCH2CH3+H218O,
故答案為:CH3CO18OH+CH3CH2OH  CH3COOCH2CH3+H218O;
CH3COOCH2CH3+H218O;
(3)儀器A的名稱是分液漏斗,圓底燒瓶受熱不均,球形干燥管的管口伸入液面下可能發生倒吸,球形干燥管體積大,可以防止倒吸,同時起冷凝作用;碳酸根水解CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,溶液呈堿性,加入幾滴酚酞,溶液呈紅色;碳酸鈉水解呈堿性,乙酸乙酯不溶于飽和碳酸鈉溶液,密度比水小,溶液分層,上層無色油體液體,乙酸和碳酸鈉反應而使溶液紅色變淺,
故答案為:分液漏斗;冷卻蒸汽;防止倒吸;CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-;溶液分層,上層無色油體液體,下層溶液顏色變淺;溶液分層,上層為無色油狀液體,下層溶液顏色變淺(或褪去);
(4)用分液法分離和提純乙酸乙酯,然后用氯化鈣除去少量乙醇,用無水硫酸鈉除去少量的水,無水硫酸鈉吸水形成硫酸鈉結晶水合物;乙酸乙酯的沸點為77℃,所以蒸餾收集77℃左右的餾分,以得較純凈的乙酸乙酯,
故答案為:乙醇; 蒸餾.
點評 本題考查乙酸乙酯的制備,題目難度中等,注意掌握乙酸乙酯的制取原理,明確反應過程中濃硫酸、飽和碳酸鈉溶液的作用,試題有利于提高學生的分析、理解能力及化學實驗能力.


科目:高中化學 來源: 題型:選擇題
| A. | 氫氧化鋇溶液與稀硫酸混合:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 少量SO2通入到漂白粉溶液中:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO | |
| C. | 氯化鋁溶液與過量的氨水反應:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | 往明礬溶液中加入氫氧化鋇溶液至SO42-完全沉淀:Al3++2SO42-+2 Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 混合物 | 試劑 | 分離方法 | |
| ① | 溴苯(Br2) | NaOH溶液 | 分液 |
| ② | 甲烷(乙烯) | 溴水 | 洗氣 |
| ③ | 乙炔(H2S) | 硫酸銅溶液 | 洗氣 |
| ④ | 乙烯(SO2) | NaOH溶液 | 洗氣 |
| ⑤ | CO2(HCl) | 飽和碳酸氫鈉溶液 | 洗氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 )的廢水可以利用微生物電池除去,其原理如圖2所示.
)的廢水可以利用微生物電池除去,其原理如圖2所示. +2e-+H+═
+2e-+H+═ +Cl-.
+Cl-.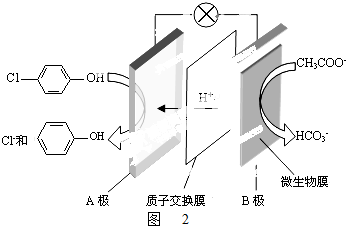
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | KClO3 和SO3 溶于水后能導電,故KClO3和SO3為電解質 | |
| B. | 25℃時、用醋酸溶液滴定等濃度NaOH 溶液至pH=7,V醋酸<VNaOH | |
| C. | 向NaAlO2 溶液中滴加NaHCO3 溶液,有沉淀和氣體生成 | |
| D. | AgCl 易轉化為AgI 沉淀且K(AgX)=c(Ag+ )•c(X-),故K(AgI)<K(AgCl) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用稀HNO3溶液溶解FeS固體:FeS+2H+═Fe2++H2S | |
| B. | Fe2(SO4)3的酸性溶液中通過足量硫化氫:2Fe3++H2S═2Fe2++S↓+2H+ | |
| C. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3+2HClO | |
| D. | 酸性條件下KIO3溶液與KI溶液反應生成I2:IO3-+5I-+3H2O═3I2+6OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 普通鋅錳干電池的簡圖(如圖所示),它是用鋅皮制成的鋅筒作電極兼做容器,中央插一根碳棒,碳棒頂端加一銅帽.在石墨碳棒周圍填滿二氧化錳和炭黑的混合物,并用離子可以通過的長纖維紙包裹作隔膜,隔膜外是用氯化鋅、氯化銨和淀粉等調成糊狀作電解質溶液;該電池工作時的總反應為:Zn+2NH4++2MnO2═[Zn(NH3)2]2++Mn2O3+H2O關于鋅錳干電池的下列說法中正確的是( )
普通鋅錳干電池的簡圖(如圖所示),它是用鋅皮制成的鋅筒作電極兼做容器,中央插一根碳棒,碳棒頂端加一銅帽.在石墨碳棒周圍填滿二氧化錳和炭黑的混合物,并用離子可以通過的長纖維紙包裹作隔膜,隔膜外是用氯化鋅、氯化銨和淀粉等調成糊狀作電解質溶液;該電池工作時的總反應為:Zn+2NH4++2MnO2═[Zn(NH3)2]2++Mn2O3+H2O關于鋅錳干電池的下列說法中正確的是( )| A. | 當該電池電壓逐漸下降后,利用電解原理能重新充電復原 | |
| B. | 電池負極的電極反應式為:2MnO2+2NH4++2e-═Mn2O3+2NH3+H2O | |
| C. | 該電池碳棒可用銅棒代替,但是工作電壓會下降 | |
| D. | 外電路中每通過0.1 mol電子,鋅的質量理論上減小6.5g |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com