
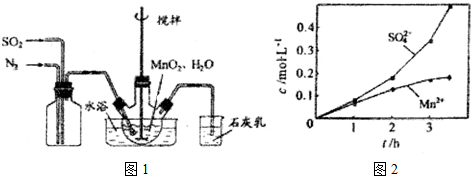
分析 (1)①根據題中所示的石灰乳的作用是吸收尾氣二氧化硫來回答;
②根據實驗的操作原則,為了讓氣體盡可能轉化,要根據反應所需的條件和用量嚴格操作;
③考慮氮氣的化學性質穩定,空氣中氧氣的活潑性等因素的影響;
(2)制取的原理是碳酸根和錳離子之間反應生成碳酸錳的過程,但要考慮MnCO3難溶于水、乙醇并在潮濕時易被空氣氧化,100℃開始分解以及Mn(OH)2開始沉淀時pH=7.7等因素,過程中控制溶液的PH值以及洗滌沉淀所選的溶劑要小心,據此答題.
解答 解:(1)①石灰乳的作用是吸收尾氣二氧化硫,堿和酸性氧化物反應得到對應的鹽和水,反應方程式為SO2+Ca(OH)2=CaSO3+H2O,
答案為:SO2+Ca(OH)2=CaSO3+H2O;
②為使SO2盡可能轉化完全,應定要保證控制反應的溫度,在通入SO2和N2比例一定、不改變固液投料的條件下,要求所通氣體一定要慢,
故答案為:控制適當的溫度、緩慢通入混合氣體;
③氮氣的化學性質穩定,空氣中氧氣性質活潑,在Mn2+催化作用下,易把亞硫酸氧化成硫酸,而使硫酸根濃度增大,
故答案為:Mn2+催化氧氣與亞硫酸反應生成硫酸;
(2)制取的原理是碳酸根和錳離子之間反應生成碳酸錳的過程,但要考慮MnCO3難溶于水、乙醇并在潮濕時易被空氣氧化,100℃開始分解以及Mn(OH)2開始沉淀時pH=7.7等因素,過程中控制溶液的PH值以及洗滌沉淀所選的溶劑要小心,所以實驗步驟為)①邊攪拌邊加入 Na2CO3,并控制溶液pH<7.7;②過濾,用少量水洗滌2~3次;③檢驗SO42-是否被洗滌干凈:取最后一次洗滌液于試管中,滴加BaCl2溶液,再滴加稀鹽酸,若無沉淀生成,則洗滌干凈;④用少量C2H5OH洗滌;⑤低于100℃干燥,
故答案為:①Na2CO3;pH<7.7;②過濾,用少量水洗滌2~3次;③取最后一次洗滌液于試管中,滴加BaCl2溶液,再滴加稀鹽酸,若無沉淀生成,則洗滌干凈;⑤低于100℃干燥.
點評 本題主要考查了制備高純碳酸錳實驗方案,讀懂工藝流程,正確識圖、理解離子反應的本質是解答的關鍵,本題實驗綜合性強,難度中等.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 0.01mol/L NH4Al(SO4)2溶液與0.01mol•L-1Ba(OH)2溶液等體積混合NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| B. | 用惰性電極電解CuCl2溶液:2Cu2++2H2O$\frac{\underline{\;電解\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | 將標準狀況下的11.2L氯氣通入200mL2mol•L-1的FeBr2溶液中,離子反應方程式為:4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl- | |
| D. | 鐵粉中滴加少量濃硝酸:Fe+3NO3-+6H+=Fe3++3NO2↑+3H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該溶液中:c2(H+)≠c(H+)•c(A-)+Kw | |
| B. | 0.1mol•L-1 HA溶液與0.05mol•L-1 NaOH溶液等體積混合,所得溶液中:2c(H+)+c(HA)═c(A-)+2c(OH-) | |
| C. | 濃度均為0.1mol•L-1的HA和NaA溶液等體積混合,所得溶液中:c(A-)>c(HA)>c(Na+)>c(OH-)>c(H+) | |
| D. | 由pH=3的HA溶液與pH=11的NaOH溶液等體積混合,所得溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使用容量瓶前必須檢查容量瓶是否漏水 | |
| B. | 容量瓶用蒸餾水洗凈后,再用待配溶液潤洗 | |
| C. | 稱好的固體試樣需用紙條小心地送入容量瓶中 | |
| D. | 搖勻后發現凹液面下降,再加水至刻度線 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
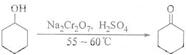
| 物質 | 沸點(℃) | 密度(g-cm-3,20℃) | 溶解性 |
| 環己醇 | 161.1(97.8)* | 0.9624 | 能溶于水 |
| 環己酮 | 155.6(95)* | 0.9478 | 微溶于水 |
| 水 | 100.0 | 0.9982 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
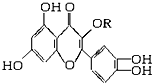 天然維生素P(結構如圖,分子結構中R為飽和烴基)存在于槐樹花蕾中,它是一種營養增補劑,關于維生素P的敘述正確的是( )
天然維生素P(結構如圖,分子結構中R為飽和烴基)存在于槐樹花蕾中,它是一種營養增補劑,關于維生素P的敘述正確的是( )| A. | 1mol該物質可與5molNaOH發生反應 | |
| B. | 1mol該物質與足量溴水反應,最多消耗6molBr2 | |
| C. | 一定條件下1mol該物質可與H2加成,消耗H2最大量為6mol | |
| D. | 維生素P能發生水解反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①④⑥ | B. | ①②④⑤⑥ | C. | ①④⑤⑥ | D. | 全部 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com