


科目:高中化學 來源: 題型:
| A、所得溶液中的c(H+)=1.0×10-13mol?L-1 |
| B、所得溶液中由水電離產生的c(OH-)=1.0×10-13 mol?L-1 |
| C、所得溶液中的c(Mg2+)=5.6×10-10 mol?L-1 |
| D、298K時,飽和Mg(OH)2的溶液與飽和MgF2溶液相比前者的c(Mg2+)大 |
查看答案和解析>>
科目:高中化學 來源: 題型:
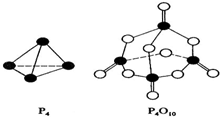

查看答案和解析>>
科目:高中化學 來源: 題型:
| A、濃硝酸和氯水用棕色試劑瓶保存 |
| B、硫化鈉和亞硫酸鈉固體長期暴露在空氣中變質 |
| C、常溫下鐵和鉑都不溶于濃硝酸 |
| D、SO2和Na2SO3溶液都能使氯水褪色 |
查看答案和解析>>
科目:高中化學 來源: 題型:
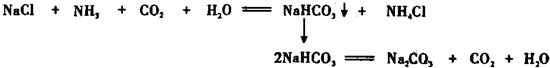
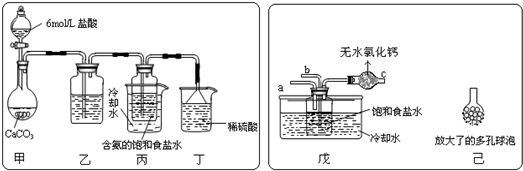
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、降低溫度 |
| B、增大壓強 |
| C、增大CO的濃度 |
| D、使用催化劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:
 已知:pAg=-lg{c(Ag+)},KspAgCl=1×10-12,如圖是向10mL AgNO3溶液中逐漸加入0.1mol/L的NaCl溶液時,溶液的pAg隨著加入NaCl溶液的體積(單位mL)變化的圖象(實線).根據圖象所得下列結論正確的是( )(提示:KspAgCl>KspAgI)
已知:pAg=-lg{c(Ag+)},KspAgCl=1×10-12,如圖是向10mL AgNO3溶液中逐漸加入0.1mol/L的NaCl溶液時,溶液的pAg隨著加入NaCl溶液的體積(單位mL)變化的圖象(實線).根據圖象所得下列結論正確的是( )(提示:KspAgCl>KspAgI)| A、原AgNO3溶液的物質的量濃度為0.1 mol?L-1 |
| B、圖中x點的坐標為(100,6 ) |
| C、圖中x點表示溶液中Ag+與Cl-濃度相同 |
| D、把0.1 mol?L-1的NaCl換成0.1 mol?L-1NaI則圖象在終點后變為虛線部分 |
查看答案和解析>>
科目:高中化學 來源: 題型:
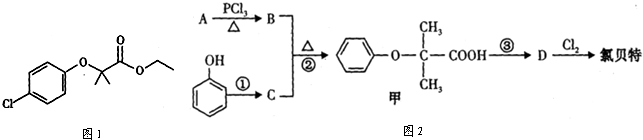
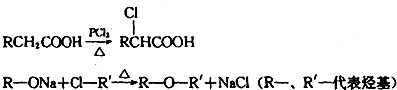
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com