
分析 ①氧族元素的氫化物的酸性,從上到下逐漸增強;
②多元弱酸鹽的第一步水解程度大于第二步水解;
③酸性越強,對應鹽的水解程度越強;
④鹽的水解程度越大,水的電離程度越大;
⑤弱酸鹽水解顯堿性,酸越弱,鹽的水解程度越大.
解答 解:①氧族元素的氫化物的酸性,從上到下逐漸增強,則酸性:H2S<H2Se,故錯誤;
②多元弱酸鹽的第一步水解程度大于第二步水解,水解程度越大,溶液的堿性越強,所以堿性:Na2S>NaHS,故正確;
③酸性越強,對應鹽的水解程度越大,溶液的堿性越強,酸性:HCOOH>CH3COOH,則堿性:HCOONa<CH3COONa,故錯誤;
④鹽的水解程度越大,水的電離程度越大,醋酸的酸性大于氫氧化鋁,則NaAlO2的水解程度大,所以水的電離程度:NaAc<NaAlO2,故正確;
⑤弱酸鹽水解顯堿性,酸越弱,鹽的水解程度越大,Na2SO4不水解溶液顯中性,NaHSO3顯酸性,NaClO的水解程度大于NaHCO3,所以溶液的pH:NaHSO3<Na2SO4<NaHCO3<NaClO,故正確;
所以不正確的是①③.
故答案為;①③.
點評 本題考查了酸性強弱的比較、鹽的水解原理的應用等知識點,難度中等,注意電離程度越小的物質,其陰離子結合氫離子能力越強,即水解程度越大.


科目:高中化學 來源: 題型:選擇題
| A. | 1 mol H2SO4與1 mol Ba(OH)2完全中和所放出的熱量為中和熱 | |
| B. | 強酸和強堿的稀溶液發生中和反應一定是放熱反應,弱酸和弱堿反應一定也是放熱反應 | |
| C. | CO是不穩定的氧化物,它能繼續和氧氣反應生成穩定的CO2,故反應一定是吸熱反應 | |
| D. | 酸和堿發生中和反應生成1 mol 水,這時的反應熱叫中和熱 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙烯的結構簡式:CH2CH2 | |
| B. | 硝基苯的結構簡式: | |
| C. | (CH3 CH2)2 CHCH2CH3 的名稱:2-乙基丁烷 | |
| D. | 甲基的電子式為: |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
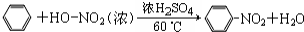 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,32gO2和O3的混合氣體所含原子數為2NA | |
| B. | 將7.1g氯氣通入足量水中發生反應,所轉移的電子數為0.1NA | |
| C. | 標準狀況下,11.2LSO2中含有的分子數為0.5NA | |
| D. | 23g鈉與足量氧氣充分反應,轉移的電子數一定是NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分子式為C6H14含有四個甲基的烴的一氯取代物的異構體數目為5 | |
| B. | 分子式為C5H10異構體數目為5 | |
| C. | 分子式為C4H10O的醇類異構體數目為4 | |
| D. | 分子式為C6H12O2羧酸類異構體數目為8 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 編號 | 實驗內容 | 實驗目的 |
| A | 用平行光照射 | 區別淀粉溶液和氯化鈉溶液 |
| B | 加入CaCO3粉末,充分反應后過濾 | 除去CaCl2溶液中的FeCl3 |
| C | 通過灼燒的Cu粉末,收集氣體 | 除去N2中的少量O2 |
| D | 滴入稀鹽酸,同時用pH計測定至溶液呈中性 | 除去KNO3溶液中的KOH |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com