
| A. | 乙烯的結構簡式:CH2CH2 | |
| B. | 硝基苯的結構簡式: | |
| C. | (CH3 CH2)2 CHCH2CH3 的名稱:2-乙基丁烷 | |
| D. | 甲基的電子式為: |
分析 A.乙烯分子中含有碳碳雙鍵,其結構簡式中沒有標出官能團結構;
B.硝基中N原子與苯環的C相連;
C.烷烴的命名中出現2-乙基,說明選取的主鏈錯誤;
D.甲基為中性原子團,碳原子最外層含有7個電子.
解答 解:A.乙烯分子中含有碳碳雙鍵,其正確的結構簡式為:CH2=CH2,故A錯誤;
B.硝基苯中,硝基的N原子與苯環相連,硝基苯正確的結構簡式為: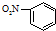 ,故B錯誤;
,故B錯誤;
C.(CH3 CH2)2CHCH2CH3 的最長碳鏈含有5個C,主鏈為戊烷,其正確名稱為:3-乙基戊烷,故C錯誤;
D.甲基中含有3個C-H鍵,碳原子最外層含有7個電子,其電子式為 ,故D正確;
,故D正確;
故選D.
點評 本題考查了常見化學用語的表示方法,題目難度中等,涉及電子式、結構簡式、有機物命名等知識,明確常見化學用語的書寫原則為解答關鍵,試題培養了學生的規范答題能力.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | He | B. | S | C. | Si | D. | P |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 工業上,用焦炭在電爐中還原二氧化硅得到含雜質的粗硅 | |
| B. | 煤經過氣化和液化兩個物理變化,可變為清潔能源 | |
| C. | 如將納米材料分散到液體分散劑中,該分散系可發生丁達爾現象,由此可推測納米材料的直徑為1~100 nm之間 | |
| D. | 將苦鹵濃縮、氧化,鼓入熱空氣或水蒸氣提取海水中的溴,溴元素又稱“海洋元素” |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 正常人血液內Kw=10-14 | |
| B. | 由題給數據可算得正常人血液的pH約為7.4 | |
| C. | 正常人血液中存在:c(HCO3-)+c(OH-)+2c(CO32-)=c(H+)+c(H2CO3) | |
| D. | 當過量的堿進入血液中時,只發生HCO3-+OH-=CO32-+H2O的反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C3H8 | B. | C8H16 | C. | C8H8 | D. | C3H4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HCl分子的電子式H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{Cl}}{••}$${\;}_{•}^{•}$]- | |
| B. | 乙炔分子的結構式CH≡CH | |
| C. | H2O分子的比例模型 | |
| D. | 甲烷分子的球棍模型 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com