
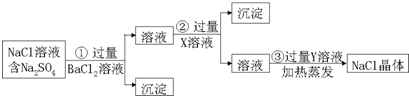
分析 根據除去NaCl固體中混有的少量Na2SO4,加入過量氯化鋇,反應生成硫酸鋇沉淀;然后加入過量碳酸鈉溶液,目的是除去剩余氯化鋇而生成碳酸鋇沉淀,再加入鹽酸可以出去多余的碳酸根離子,鹽酸具有揮發性,根據過濾和溶液中獲得溶質的方法是蒸發結晶知識進行回答.
解答 解:除去NaCl固體中混有的少量Na2SO4,加入過量氯化鋇,反應生成硫酸鋇沉淀;然后加入過量碳酸鈉溶液,目的是除去剩余氯化鋇而生成碳酸鋇沉淀,再加入鹽酸可以出去多余的碳酸根離子,可以蒸發除去.
(1)加入的X是Na2CO3,Y是HCl,故答案為:Na2CO3;HCl;
(2)加入過量碳酸鈉溶液,目的是除去剩余氯化鋇而生成碳酸鋇沉淀,即Ba2++CO32-═BaCO3↓,再加入鹽酸可以出去多余的碳酸根離子,即CO32-+2H+═H2O+CO2↑,故答案為:Ba2++CO32-═BaCO3↓;CO32-+2H+═H2O+CO2↑;
(3)從溶液中提取NaCl采用的方法是蒸發結晶,故答案為:蒸發結晶;
(4)過濾和蒸發實驗操作過程中玻璃棒的作用有攪拌、引流,除了玻璃棒外,還需要用到的玻璃儀器有漏斗、燒杯,整個過程金屬儀器除了鐵架臺外還有坩堝鉗,故答案為:攪拌、引流;漏斗、燒杯;坩堝鉗.
點評 通過回答本題知道了混合物分離的方法和除去可溶性雜質的方法,不能引入新的雜質,并且注意順序.


科目:高中化學 來源: 題型:選擇題
| A. | 在常溫常壓下,0.5 mol任何氣體的體積都必定是11.2 L | |
| B. | 在標準狀況下,1 mol任何物質的體積都約是22.4 L | |
| C. | 常溫常壓下,1 mol任何氣體的體積都約是22.4 L | |
| D. | 在標準狀況下,0.5 mol CO2所占有的體積約是11.2 L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 化合反應 | B. | 分解反應 | C. | 復分解反應 | D. | 置換反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | BaCl2、Na2CO3、NaOH、鹽酸 | B. | NaOH、BaCl2、Na2CO3、鹽酸 | ||
| C. | Na2CO3、NaOH、BaCl2、鹽酸 | D. | BaCl2、NaOH、Na2CO3、鹽酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 4個C-H鍵的長度相等 | B. | 4個C-H鍵的強度相同 | ||
| C. | 4個C-H鍵的夾角相同 | D. | 4個C-H連接成正方形 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com