
| A. | 硫酸銅晶體 | B. | HCl氣體 | C. | 氯化鋇晶體 | D. | 醋酸鉀晶體 |
分析 在鋅片和鹽酸的反應中,加入如下試劑,可使生成氫氣的速度變慢,可以通過降低溶液中氫離子濃度來實現,據此分析解答.
解答 解:A.加入硫酸銅晶體,Zn和銅離子發生置換反應生成Cu,Zn、Cu和稀鹽酸構成原電池,加快反應速率,故A不選;
B.通入HCl,HCl電離出氫離子導致溶液中氫離子濃度增大,反應速率加快,故B不選;
C.加入氯化鋇晶體,氫離子濃度不變,所以反應速率不變,故C不選;
D.加入醋酸鉀晶體,鹽酸和醋酸根離子反應生成醋酸,醋酸是弱電解質,導致溶液中氫離子濃度減小,反應速率減慢,故D正確;
故選D.
點評 本題考查化學反應速率影響因素,為高頻考點,明確濃度、溫度、催化劑、壓強、反應物接觸面積、原電池等對化學反應速率影響原理是解本題關鍵,注意溶液中氯離子濃度大小不影響反應速率,為易錯點.


科目:高中化學 來源: 題型:選擇題
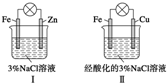
| A. | Ⅰ中不能形成原電池 | |
| B. | Ⅱ中負極反應是Fe-3e-═Fe3+ | |
| C. | Ⅱ中正極反應是O2+2H2O+4e-═4OH- | |
| D. | Ⅱ中加入少量K3[Fe(CN)6]溶液,有藍色沉淀 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氫氧化鐵溶膠、水玻璃、淀粉溶液、PM2.5微粒均具有丁達爾效應 | |
| B. | 明礬和漂白粉常用于自來水的處理,兩者的作用原理相同 | |
| C. | 氯化鐵溶液可用于制作印刷電路板是因為其具有較強氧化性,與銅發生置換反應 | |
| D. | 高溫能殺死流感病毒是因為構成病毒的蛋白質受熱變性 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
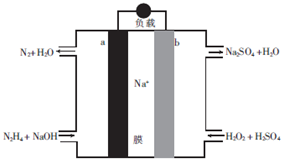
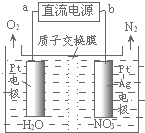
| A. | a極為電池的正極 | |
| B. | 電路中每轉移6.02×1023個電子,則有1molNa+穿過膜向正極移動 | |
| C. | b極的電極反應式為H2O2+2e-=2OH- | |
| D. | 用該電池電解飽和食鹽水,當陽極生成2.24L(標準狀況)Cl2時,消耗肼0.1mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
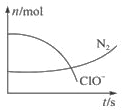 某容器中發生一個化學反應,反應過程存在H2O、ClO-、CN-、HCO3-、N2、Cl-6種物質.在反應過程中測得ClO-和N2的物質的量隨時間變化的曲線如圖所示.下列有關判斷中正確的是( )
某容器中發生一個化學反應,反應過程存在H2O、ClO-、CN-、HCO3-、N2、Cl-6種物質.在反應過程中測得ClO-和N2的物質的量隨時間變化的曲線如圖所示.下列有關判斷中正確的是( )| A. | 當有3 mol ClO-參加反應時,則有1 mol N2生成 | |
| B. | HCO3-作為堿性介質參與反應 | |
| C. | 當有5 mol ClO-參加反應時,則有1 mol N2生成 | |
| D. | 若生成2.24 L N2,則轉移電子0.6 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
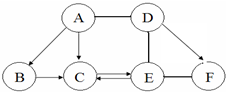 如圖 A、B、C、D、E、F為初中化學常見的六種含氧化合物,A、B、C 均由兩種元素組成,在常溫下狀態各不相同,其中A為紅色粉末,D、E、F 均由三種元素組成,且物質類別各不相同.“→”表示物質間的轉化關系,“-”表示兩種物質能相互反應(部分反應物、生成物及反應條件未標出).回答下列問題:
如圖 A、B、C、D、E、F為初中化學常見的六種含氧化合物,A、B、C 均由兩種元素組成,在常溫下狀態各不相同,其中A為紅色粉末,D、E、F 均由三種元素組成,且物質類別各不相同.“→”表示物質間的轉化關系,“-”表示兩種物質能相互反應(部分反應物、生成物及反應條件未標出).回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 發生在天津港“8•12”特大火災爆炸事故,再一次引發了人們對環境問題的關注.
發生在天津港“8•12”特大火災爆炸事故,再一次引發了人們對環境問題的關注.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 10% | B. | 33.3% | C. | 50% | D. | 66.7% |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com