
| A. | Cl2與H2O反應:Cl2+H2O═2H++ClO-+Cl- | |
| B. | 往FeCl3溶液中加入Cu粉:Fe3++Cu═Fe2++Cu2+ | |
| C. | 向AlCl3溶液中滴加氨水至過量:Al3++3OH-═Al(OH)3↓ | |
| D. | 將銅片投入濃硝酸中:2NO3-+Cu+4H+═Cu2++2NO2↑+2H2O |
分析 A.次氯酸為弱酸,離子方程式中次氯酸不能拆開;
B.離子方程式兩邊正電荷不相等,違反了電荷守恒;
C.氨水為弱堿,離子方程式中一水合氨不能拆開;
D.銅與濃硝酸反應生成硝酸銅、二氧化氮氣體和水.
解答 解:A.Cl2與H2O反應生成氯化氫和次氯酸,正確的離子方程式為:Cl2+H2O═H++HClO+Cl-,故A錯誤;
B.往FeCl3溶液中加入Cu粉,反應生成硫化銅和氯化亞鐵,正確的離子方程式為:2Fe3++Cu═2Fe2++Cu2+,故B錯誤;
C.向AlCl3溶液中滴加氨水至過量,一水合氨不能拆開,正確的離子方程式為:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故C錯誤;
D.銅片投入濃硝酸中生成二氧化氮氣體,反應的離子方程式為:2NO3-+Cu+4H+═Cu2++2NO2↑+2H2O,故D正確;
故選D.
點評 本題考查了離子方程式的正誤判斷,題目難度中等,注意掌握離子方程式的書寫原則,明確離子方程式正誤判斷常用方法:檢查反應物、生成物是否正確,檢查各物質拆分是否正確,如難溶物、弱電解質等需要保留化學式,檢查是否符合守恒關系(如:質量守恒和電荷守恒等)等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | B | ||||||
| 2 | D | E | F | G | ||||
| 3 | C | H | I |
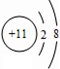 ,I的原子結構示意圖
,I的原子結構示意圖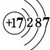 .
.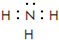 ;該物質溶于水后的溶液呈堿性(填“酸”、“堿”或“中”).
;該物質溶于水后的溶液呈堿性(填“酸”、“堿”或“中”).查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 運用有關知識,回答下列問題.
運用有關知識,回答下列問題.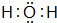 ,實驗室中檢驗C的試劑及現象是濕潤的紅色石蕊試紙變藍色.
,實驗室中檢驗C的試劑及現象是濕潤的紅色石蕊試紙變藍色.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 元素周期表是按照元素相對原子質量大小排列而成的 | |
| B. | 元素周期表有7個橫行,也是7個周期;有18個縱行,即18個族 | |
| C. | 凡是位于元素周期表中同一周期的元素,都是按從左到右的順序原子最外層電子數由1遞增到8 | |
| D. | 凡是位于元素周期表中同一主族的元素,都是按從上到下的順序電子層數逐漸增多 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
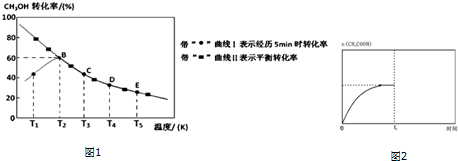
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
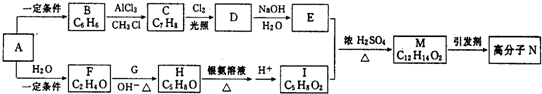
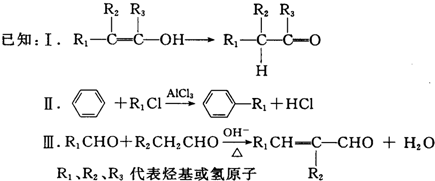
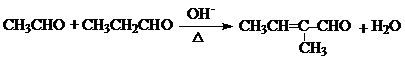 .
.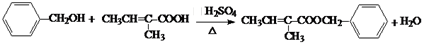 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 所得溶液中C(Fe2+):C(Fe3+)=1:1 | B. | 所得溶液中C(NO3-)=2.75mol/L | ||
| C. | 反應后生成NO的體積為28 L | D. | 所得溶液中溶質只有FeSO4和K2SO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 2015年8月12日天津港發生了危化品特大爆炸事故,爆炸倉庫存有大量氰化鈉(NaCN)、硝酸銨、四氯化鈦等物品.
2015年8月12日天津港發生了危化品特大爆炸事故,爆炸倉庫存有大量氰化鈉(NaCN)、硝酸銨、四氯化鈦等物品.| 物質 | Cl2 | TiCl4 | O2 |
| 濃度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com