
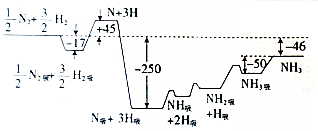
 化學反應原理在工業生產中具有十分重要的意義.
化學反應原理在工業生產中具有十分重要的意義.分析 (1)①根據圖和已有的機理,可推斷出A、D兩個反應;
②由圖可以看出生成1molNH3,△H=-46kJ•mol-1,氣體分子數改變的反應,在一定體積的容器中,壓強保持不變是平衡狀態.
解答 解:(1)由圖可知該反應的機理是H2→H2吸→2H→2H吸,N2吸→2N→2N吸,N吸+H吸→NH吸→NH2吸→NH3吸→NH3,
則A的反應為N2吸?2N?2N吸,
D的反應為NH吸+H吸?NH2吸;
故答案為:N2吸?2N?2N吸;NH吸+H吸?NH2吸;
②由圖可以看出生成1molNH3,△H=-46kJ•mol-1,則反應的熱化學方程式為N2(g)+3H2(g)?2NH3(g);H=-92kJ•mol-1,
故答案為:N2(g)+3H2(g)?2NH3(g);H=-92kJ•mol-1.
點評 本題很好的將化學平衡、電離平衡、反應熱結合在一塊,雖然題目引入了諾貝爾獎的有關背景,但高起點低落點,這種命題方法是高考的常用方法,一定要考慮清楚是否運用信息或搞清楚哪些是干擾信息.


科目:高中化學 來源: 題型:選擇題
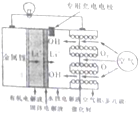 如圖所示是一種新型的鋰空氣電池,該新型鋰一空氣電池無需充電,只需更換正極的水性電解液,通過卡盒等方式更換負極的金屬鋰就可以連續使用,正極生成的氫氧化鋰可以從使用過的水性電解液中回收,再提煉出金屬鋰,金屬鋰則可再次作為原料循環使用,下列有關該鋰電池的敘述不正確的是( )
如圖所示是一種新型的鋰空氣電池,該新型鋰一空氣電池無需充電,只需更換正極的水性電解液,通過卡盒等方式更換負極的金屬鋰就可以連續使用,正極生成的氫氧化鋰可以從使用過的水性電解液中回收,再提煉出金屬鋰,金屬鋰則可再次作為原料循環使用,下列有關該鋰電池的敘述不正確的是( )| A. | 放電時,鋰離子(Li+)穿過固體電解質移到負極的水性電解液中 | |
| B. | 充電時,陽極的電極反應式為:4OH--4e-=O2+2H2O | |
| C. | 熔融的氫氧化鋰用惰性電極電解再生時,在陰極可得到金屬鋰,放電時負極的電極反應式為:Li-e-=Li+ | |
| D. | 充電時,鋰極與外電源的負極相連 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加入少量H2 C2O4固體,促進水電離,溶液中c(H+)增大 | |
| B. | 加入NaOH溶液至恰好完全反應,則溶液中:c(Na+)>c(C2O42-)>c(HC2O4-)>c(H+) | |
| C. | 加入氨水至中性,則溶液中:c(NH4+)+c(Na+)=2c(C2O42-)+c(HC2O4-) | |
| D. | 加入0.01 mol Na2C2O4固體,則溶液中:3c(Na+)=2[c(H2C2O4)+c(HC2O4- )+c(C2O42-)] |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
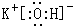 .
.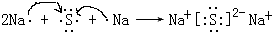 ,該化合物屬于離子(填“共價”或“離子”)化合物.
,該化合物屬于離子(填“共價”或“離子”)化合物.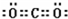 ,該化合物是由極性(填“極性”“非極性”)鍵形成的.
,該化合物是由極性(填“極性”“非極性”)鍵形成的.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鹽酸的酸性比氫硫酸(H2S水溶液)酸性強 | |
| B. | Cl2與鐵反應生成FeCl3,而S與鐵反應生成FeS | |
| C. | Cl2能與H2S反應生成S | |
| D. | 還原性:Cl-<S2- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 利用鋁熱反應焊接鋼軌:2Al+Fe2O3$\frac{\underline{\;高溫\;}}{\;}$ 2Fe+Al2O3 | |
| B. | 用氯水除去FeCl3溶液中的Fe2+:Cl2+Fe2+═2Cl-+Fe3+ | |
| C. | 用已知濃度的NaOH溶液測定未知濃度的醋酸溶液的濃度:H++OH-═H2O | |
| D. | 盛放NaOH溶液的試劑瓶不能用玻璃塞:SiO2+2Na++2OH-═Na2SiO3+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
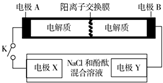 某二次電池充、放電的化學方程式為:2K2S2+KI3$→_{充電}^{放電}$K2S4+3KI.與其它設備連接的電路如圖示.當閉合開關K時,X附近溶液先變紅.則下列說法正確的是( )
某二次電池充、放電的化學方程式為:2K2S2+KI3$→_{充電}^{放電}$K2S4+3KI.與其它設備連接的電路如圖示.當閉合開關K時,X附近溶液先變紅.則下列說法正確的是( )| A. | K+從右到左通過離子交換膜 | |
| B. | A的電極反應式為:3I--2e-=I3- | |
| C. | 當有0.1 mol K+通過離子交換膜,X電極上產生氣體1.12 L(標準狀況下) | |
| D. | 電池充電時,B電極要與外電源的正極相連,電極上發生還原反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
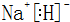 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH2O2和C3H6O2一定互為同系物 | |
| B. | 碳酸鈉溶液可用于鑒別乙酸和乙酸乙酯 | |
| C. | 用溴水可以除去溶解在苯中的少量苯酚 | |
| D. | 糧食釀酒過程中,淀粉在酶的催化作用下最終水解為乙醇 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com