
| A. | 溶液、膠體、濁液屬于不同的分散系 | |
| B. | 膠體與其他分散系的本質區別是膠體分散質粒子直徑在1nm-100nm之間 | |
| C. | 可利用丁達爾現象鑒別溶液和膠體 | |
| D. | 利用過濾的方法可以分離膠體和溶液 |
分析 A.溶液、膠體、濁液分散質粒子的大小不同;
B.分散質粒子的大小不同是分散系的本質區別;
C.溶液無丁達爾效應,膠體有丁達爾效應;
D.膠體和溶液都能透過濾紙.
解答 解:A.分散質微粒直徑,小于1nm的形成分散系為溶液,大于100nm為濁液,1-100nm的為膠體,故A正確;
B.分散質粒子的大小不同是分散系的本質區別,分散質微粒直徑,小于1nm的形成分散系為溶液,大于100nm為濁液,1-100nm的為膠體,故B正確;
C.丁達爾效應是膠體的獨有性質,而溶液物此性質,利用丁達爾效應鑒別膠體和溶液,故C正確;
D.膠體和溶液都能透過濾紙,所以不能用過濾的方法分離膠體和溶液,故D錯誤.
故選D.
點評 本題考查膠體的性質,題目難度不大,本題易錯點為C,注意膠體有介穩性,丁達爾效應是膠體的獨有性質.


科目:高中化學 來源: 題型:解答題
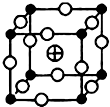 鹵族元素是典型的非金屬元素,鹵素單質及其化合物在生產和生活中都有重要的用途.
鹵族元素是典型的非金屬元素,鹵素單質及其化合物在生產和生活中都有重要的用途. 、
、 、
、 分別代表一種離子),晶胞邊長為anm(1nm=10-9m),該晶體的化學式為KMgF3,該晶體的密度為$\frac{0.1993}{{a}^{3}}$g•cm-3.
分別代表一種離子),晶胞邊長為anm(1nm=10-9m),該晶體的化學式為KMgF3,該晶體的密度為$\frac{0.1993}{{a}^{3}}$g•cm-3.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 A、B、C、D、E 分別代表中學化學中的常見物質,請根據題目要求回答下列問題:
A、B、C、D、E 分別代表中學化學中的常見物質,請根據題目要求回答下列問題: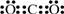 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

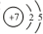 ,其單質的電子式為
,其單質的電子式為 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 碳酸鈣與鹽酸混合:2H++CO32-═CO2↑+H2O | |
| B. | Al投入NaOH溶液中:Al+OH-+H2O═AlO2-+H2↑ | |
| C. | 亞硫酸鈉溶液與稀硫酸混合:2H++SO32-═SO2↑+H2O | |
| D. | 二氧化錳與濃鹽酸混合后加熱:MnO2+4H++4Cl-═MnCl2+Cl2↑+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
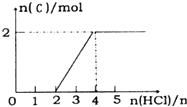
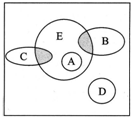 如圖方框內區域表示所有的化學反應,大圈內區域表示氧化還原反應,大圈外區域表示非氧化還原反應,其中A~D分別表示4種基本反應類型.
如圖方框內區域表示所有的化學反應,大圈內區域表示氧化還原反應,大圈外區域表示非氧化還原反應,其中A~D分別表示4種基本反應類型.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
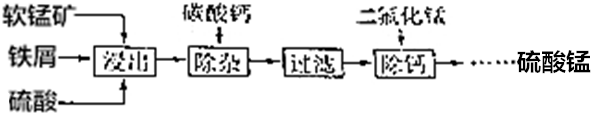
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com