
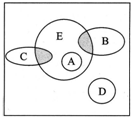
 如圖方框內區域表示所有的化學反應,大圈內區域表示氧化還原反應,大圈外區域表示非氧化還原反應,其中A~D分別表示4種基本反應類型.
如圖方框內區域表示所有的化學反應,大圈內區域表示氧化還原反應,大圈外區域表示非氧化還原反應,其中A~D分別表示4種基本反應類型.分析 根據化學反應的分類標準進行回答;
(1)化學反應的四種基本類型:化合反應、分解反應、置換反應、復分解反應;
(2)根據四大基本反應類型和氧化還原反應之間的關系來回答;
(3)部分化合反應屬于氧化還原反應,部分分解反應屬于氧化還原反應,分解反應反應物一種,生成物至少兩種,化合反應反應物至少兩種,生成物只有一種;
(4)E代表的是氧化還原反應,但是不屬于四大基本反應類型.
解答 解:分類標準不一樣,化學反應的分類結果就不一樣,根據化合價是否發生變化,可以將化學反應分為氧化還原反應和非氧化還原反應;根據反應物、生成物的種類及其變化,可以將化學反應分為:化合反應、分解反應、置換反應、復分解反應,故答案為:化合價是否發生變化;反應物、生成物的種類及其變化;
(1)根據反應物、生成物的種類及其變化,可以將化學反應分為:化合反應、分解反應、置換反應、復分解反應,故答案為:化合反應;分解反應;置換反應;復分解反應;
(2)部分化合反應屬于氧化還原反應,部分分解反應屬于氧化還原反應,所有的置換反應均是氧化還原反應,所有的復分解反應均不是氧化還原反應,故答案為:分解;置換;復分解;
(3)B、C圈表示的反應部分是氧化還原反應,所以是化合反應和分解反應兩種情況,故答案為:有元素化合價變化的化合反應;有元素化合價變化的分解反應;4Na+O2=2Na2O; 2KClO3 $\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑;
(4)E代表的是氧化還原反應,但不屬于四大基本反應類型,故選D.
點評 本題主要考查的是四大基本反應類型之間的關系以及化學反應類型的判斷,難度不大.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗操作 | 實驗現象 | 實驗結論 |
| A | NaHCO3溶液與NaAlO2溶液混合 | 生成白色沉淀 | 結合H+的能力: CO32-<AlO2- |
| B | 常溫下,相同的鋁片分別投入足量的稀、濃硫酸中 | 濃硫酸中鋁片先溶解完 | 反應物濃度越大,反應速率越快 |
| C | 向2mL 2%的CuSO4溶液中加入0.5mL 1%的NaOH溶液,振蕩后加入幾滴有機試劑X的溶液,加熱 | 未出現磚紅色沉淀 | 有機試劑X中不含醛基 |
| D | 2mL 0.1mol/L的NaOH溶液中滴加2滴0.1mol/L的MgCl2溶液,再滴加2滴0.1mol/L的FeCl3溶液 | 白色沉淀轉化為紅褐色沉淀 | 溶解度: Mg(OH)2>Fe(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溶液、膠體、濁液屬于不同的分散系 | |
| B. | 膠體與其他分散系的本質區別是膠體分散質粒子直徑在1nm-100nm之間 | |
| C. | 可利用丁達爾現象鑒別溶液和膠體 | |
| D. | 利用過濾的方法可以分離膠體和溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
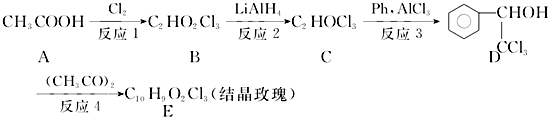
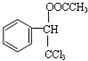 .
.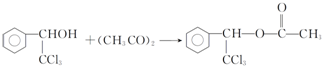 .
.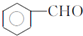 ,F與氯仿合成D的反應方程式為
,F與氯仿合成D的反應方程式為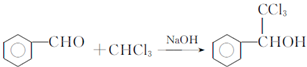 .已知2分子F在KCN存在下可通過授受H反應生成安息香
.已知2分子F在KCN存在下可通過授受H反應生成安息香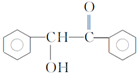 ,請寫出上述反應方程式
,請寫出上述反應方程式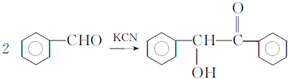 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
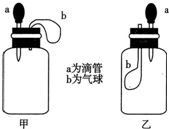 如圖所示,擠壓膠頭滴管(裝有液體)a,將液體加入到廣口瓶(裝有另一種物質)中,兩裝置中的氣球(干癟)b都有明顯地脹大(忽略液體體積對氣球的影響,以及外界和廣口瓶間熱量的傳遞影響).則所用試劑不可能是( )
如圖所示,擠壓膠頭滴管(裝有液體)a,將液體加入到廣口瓶(裝有另一種物質)中,兩裝置中的氣球(干癟)b都有明顯地脹大(忽略液體體積對氣球的影響,以及外界和廣口瓶間熱量的傳遞影響).則所用試劑不可能是( )| A. | 甲:H2O和CaO(固體);乙:H2O和NH4NO3(固體) | |
| B. | 甲:鹽酸和Na2O2(固體);乙:亞硫酸鈉溶液和氯氣 | |
| C. | 甲:NaOH溶液和CO2;乙:鹽酸和NaHCO3溶液 | |
| D. | 甲:濃H2SO4和蔗糖(固體);乙:H2O和NO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 根據如圖的物理模型,回答問題:
根據如圖的物理模型,回答問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1molCH5+與1molNH2-所含電子數均為10NA | |
| B. | 60gSiO2晶體中所含[SiO4]四面體數為0.5NA | |
| C. | 25℃,pH=10的Na2CO3溶液中所含OH-數為1×10-4NA | |
| D. | 標準狀況下,22.4LCO、NO混合氣體中所含氧原子數為2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
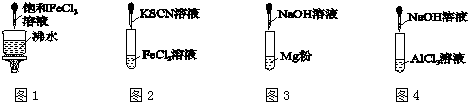
| A. | 圖1產生紅褐色沉淀 | |
| B. | 圖2溶液顏色變紅 | |
| C. | 圖3放出大量氣體 | |
| D. | 圖4先出現白色膠狀沉淀,后沉淀溶解 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com