
 .
.分析 (1)找出不同類的物質,要抓住其余5種物質的共同點,可以從物理性質和化學性質兩方面進行分析;
(2)氧化還原反應中存在元素化合價的變化,根據物質的性質結合氧化還原反應和非氧化還原反應的特征來書寫方程式;
(3)根據常見物質的轉化關系分析,氧化還原反應與離子反應不存在包含關系,但二者有交集;
(4)食醋屬于溶液,淀粉溶液屬于膠體,根據膠體的特點,可用丁達爾效應鑒別.
解答 解:(1)①根據氧元素的化合價來分類,在CO2、CaO、MgO、Fe2O3、Na2O中氧元素的化合價是-2價,但是Na2O2中元元素是-1價,故答案為:Na2O2;根據物質的類別或是化合物中氧元素的化合價;
②根據化合物CaO、MgO、Fe2O3、Na2O2、Na2O在常溫下的狀態均為固態,只有CO2是氣態,
故答案為:CO2;根據物質在常溫下的狀態;
(2)Na2O2與水反應的離子方程式是:2Na2O2+2H2O=4Na++4OH-+O2↑,在氧化還原反應中存在元素化合價的變化,在給定的物質中,堿性氧化物氧化鈣和酸性氧化物二氧化硅的反SiO2+CaO=CaSiO3應屬于非氧化還原反應,過氧化鈉具有氧化性,可以和二氧化硫反應生成硫酸鈉,即2Na2O2+2CO2=2Na2CO3+O2,
故答案為:CaO+CO2=CaCO3;2Na2O2+2CO2=2Na2CO3+O2;
(3)離子反應有的是氧化還原反應,有的不是氧化還原反應,二者的關系可以用右圖表示,
A代表氧化還原反應,B代表離子反應,其中的C代表即是氧化還原反應又是離子反應的化學反應,故答案為 :
:
;
(4)生活中的食醋屬于溶液,淀粉溶液屬于膠體,鑒別二者的方法是丁達爾現象,故答案為:溶液;膠體;丁達爾現象.
點評 該題考查了物質的分類以及氧化還原反應的特征方面的知識,該考點的基礎性比較強,主要出現在選擇題和填空題中


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溶液、膠體、濁液屬于不同的分散系 | |
| B. | 膠體與其他分散系的本質區別是膠體分散質粒子直徑在1nm-100nm之間 | |
| C. | 可利用丁達爾現象鑒別溶液和膠體 | |
| D. | 利用過濾的方法可以分離膠體和溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溶液中無法確定Al3+的存在 | |
| B. | 原溶液中不含的離子為:K+、Cu2+、CO32- | |
| C. | 步驟②中可以確定存在Cl-、Fe2+、NO3- | |
| D. | 步驟③中共有2種鋇鹽沉淀生成 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
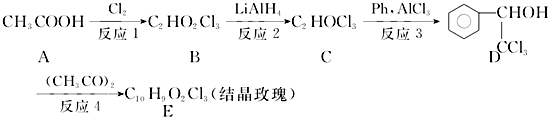
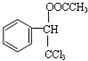 .
.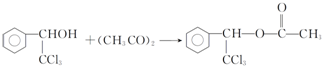 .
.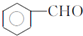 ,F與氯仿合成D的反應方程式為
,F與氯仿合成D的反應方程式為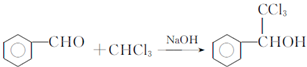 .已知2分子F在KCN存在下可通過授受H反應生成安息香
.已知2分子F在KCN存在下可通過授受H反應生成安息香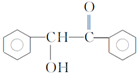 ,請寫出上述反應方程式
,請寫出上述反應方程式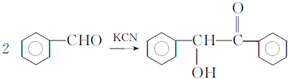 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
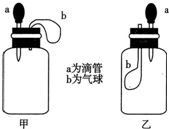 如圖所示,擠壓膠頭滴管(裝有液體)a,將液體加入到廣口瓶(裝有另一種物質)中,兩裝置中的氣球(干癟)b都有明顯地脹大(忽略液體體積對氣球的影響,以及外界和廣口瓶間熱量的傳遞影響).則所用試劑不可能是( )
如圖所示,擠壓膠頭滴管(裝有液體)a,將液體加入到廣口瓶(裝有另一種物質)中,兩裝置中的氣球(干癟)b都有明顯地脹大(忽略液體體積對氣球的影響,以及外界和廣口瓶間熱量的傳遞影響).則所用試劑不可能是( )| A. | 甲:H2O和CaO(固體);乙:H2O和NH4NO3(固體) | |
| B. | 甲:鹽酸和Na2O2(固體);乙:亞硫酸鈉溶液和氯氣 | |
| C. | 甲:NaOH溶液和CO2;乙:鹽酸和NaHCO3溶液 | |
| D. | 甲:濃H2SO4和蔗糖(固體);乙:H2O和NO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1molCH5+與1molNH2-所含電子數均為10NA | |
| B. | 60gSiO2晶體中所含[SiO4]四面體數為0.5NA | |
| C. | 25℃,pH=10的Na2CO3溶液中所含OH-數為1×10-4NA | |
| D. | 標準狀況下,22.4LCO、NO混合氣體中所含氧原子數為2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 鐵螺絲連接鋅板時,鐵不容易生銹 | |
| B. | 反應CaC03(s)=Ca0(s)+C02(g)在常溫下不能發生,則該反應的△H<0 | |
| C. | pH=11的NaOH溶液與pH=3的CH3COOH溶液混合后所得溶液pH小于7 | |
| D. | 電解精煉銅時,每轉移1mol電子陽極上溶解的銅原子數小于0.5×6.02×1023 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com