
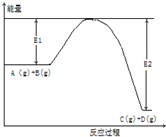
 反應A(g)+B(g)?C(g)+2D(g)的能量變化如圖所示,回答下列問題.
反應A(g)+B(g)?C(g)+2D(g)的能量變化如圖所示,回答下列問題.分析 (1)由圖可知,反應物總能量大于生成物總能量,則該反應為放熱反應;
(2)正反應為放熱反應,升高溫度平衡逆向移動;
(3)使用催化劑改變反應途徑,反應熱只與始態、狀態有關,與反應途徑無關;
(4)將1molA和2molB加入2L容器中,5min后達到平衡,此時A的轉化率為50%,參加反應A的物質的量為0.5mol,則:
A(g)+B(g)?C(g)+2D(g)
起始濃度(mol/L):0.5 1 0 0
變化濃度(mol/L):0.25 0.25 0.25 0.5
平衡濃度(mol/L):0.25 0.75 0.25 0.5
根據v=$\frac{△c}{△t}$計算v(D),根據K=$\frac{c(C)×{c}^{2}(D)}{c(A)×c(B)}$計算平衡常數.
解答 解:(1)由圖可知,反應物總能量大于生成物總能量,則該反應為放熱反應,
故答案為:放熱;
(2)正反應為放熱反應,升高溫度平衡逆向移動,A的轉化率減小,
故答案為:減小;正反應是放熱反應,升高溫度反應向逆反應方向移動;
(3)使用催化劑改變反應途徑,反應熱只與始態、狀態有關,與反應途徑無關,故△H不變,
故答案為:不變;
(4)將1molA和2molB加入2L容器中,5min后達到平衡,此時A的轉化率為50%,參加反應A的物質的量為0.5mol,則:
A(g)+B(g)?C(g)+2D(g)
起始濃度(mol/L):0.5 1 0 0
變化濃度(mol/L):0.25 0.25 0.25 0.5
平衡濃度(mol/L):0.25 0.75 0.25 0.5
則v(D)=$\frac{0.5mol/L}{5min}$=0.1mol/(L?min),
平衡常數K=$\frac{c(C)×{c}^{2}(D)}{c(A)×c(B)}$=$\frac{0.25mol/L×(0.5mol/L)^{2}}{0.25mol/L×0.75mol/L}$=0.33 mol/L,
故答案為:0.1mol/(L?min);0.33 mol/L.
點評 本題考查化學平衡計算與影響因素、平衡常數、反應速率計算、化學反應中能量變化等,比較基礎,注意掌握三段式在化學平衡計算中應用.


 千里馬走向假期期末仿真試卷寒假系列答案
千里馬走向假期期末仿真試卷寒假系列答案科目:高中化學 來源: 題型:選擇題
| A. | a=b | B. | HA與BOH的電離常數相等 | ||
| C. | 混合溶液中,c(H+)=$\sqrt{{K}_{W}}$mol/L | D. | 混合溶液中,c(H+)+c(B+)═c(OH-)+c(A-) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 CO2和CH4是兩種重要的溫室氣體,通過CH4和CO2反應制造更高價值化學品是目前的研究目標.
CO2和CH4是兩種重要的溫室氣體,通過CH4和CO2反應制造更高價值化學品是目前的研究目標.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 綠色化學的核心是從源頭上消除工業生產對環境的污染 | |
| B. | “硫黃姜”又黃又亮,可能是在用硫黃熏制的過程中產生的SO2所致 | |
| C. | 鐵在潮濕的空氣中放置,易發生化學腐蝕而生銹 | |
| D. | 華裔科學家高琨在光纖傳輸信息領域中取得突破性成就,光纖的主要成分是高純度的二氧化硅 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com