
分析 n(Cu)=$\frac{19.2g}{64g/mol}$=0.3mol,Cu和稀硝酸反應生成硝酸銅、NO和水,二者恰好完全反應,
(1)根據轉移電子守恒計算NO體積;
(2)根據N原子守恒得n(HNO3)=2n[Cu(NO3)2]+n(NO),再根據c=$\frac{n}{V}$計算c(HNO3).
解答 解:n(Cu)=$\frac{19.2g}{64g/mol}$=0.3mol,Cu和稀硝酸反應生成硝酸銅、NO和水,二者恰好完全反應,
(1)根據轉移電子守恒得V(NO)=$\frac{0.3mol×2}{(5-2)}×22.4L/mol$=4.48L,
答:在標況下生成NO體積為4.48L;
(2)根據N、Cu原子守恒得n(HNO3)=2n[Cu(NO3)2]+n(NO)=2n(Cu)+n(NO)=2×0.3mol+$\frac{0.3mol×2}{5-2}$=0.8mol,c(HNO3)=$\frac{n}{V}$=$\frac{0.8mol}{0.4L}$=2mol/L,
答:原硝酸的物質的量的濃度是2mol/L.
點評 本題考查氧化還原反應計算,為高頻考點,明確反應中轉移電子守恒、原子守恒是解本題關鍵,注意守恒法在計算中的靈活運用,題目難度不大.


 長江作業本同步練習冊系列答案
長江作業本同步練習冊系列答案科目:高中化學 來源: 題型:解答題
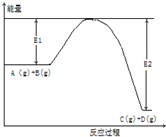 反應A(g)+B(g)?C(g)+2D(g)的能量變化如圖所示,回答下列問題.
反應A(g)+B(g)?C(g)+2D(g)的能量變化如圖所示,回答下列問題.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
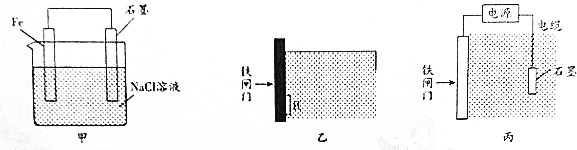
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | K+,Mg2+,Cl-,OH- | B. | Na+,Cu2+,CO32-,NO3- | ||
| C. | H+,Na+,CO32-,Cl- | D. | Na+,Mg2+,Cl-,SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 含1mo1K0H的溶液與1mo1CO2完全反應后,溶液中c(K+)>c(HCO3- ) | |
| B. | 0.2mo1/LCH3COOH溶液與0.1mo1/LNaOH溶液等體積混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| C. | 將100mL0.1mo1.L-1的醋酸稀釋至pH=4:n(CH3COO-)+n(CH3COOH)=0.01mo1 | |
| D. | pH=5的NaHSO3溶液中:c(HSO3-)+c(SO32-)=c(Na+) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
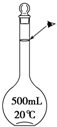 實驗室配制500mL 0.1mol•L-1的NaCl溶液,有如下操作步驟:
實驗室配制500mL 0.1mol•L-1的NaCl溶液,有如下操作步驟:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 圖是學校實驗室從化學試劑商店買回的硫酸試劑標簽上的部分內容,據此,回答問題:
圖是學校實驗室從化學試劑商店買回的硫酸試劑標簽上的部分內容,據此,回答問題:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com