
| 元素代號 | L | M | Q | R | T |
| 原子半徑/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合價 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氫化物的沸點為H2T<H2R | |
| B. | M和T形成的化合物既能與強酸反應又能與強堿反應 | |
| C. | 單質與等濃度的稀鹽酸反應的劇烈程度為Q>L | |
| D. | L2+與R2-的核外電子數相等 |
分析 短周期元素,由元素的化合價可知,T、R都有-2價,而R有+6價且原子半徑較大,則T為O元素,R為S元素,L、Q均有+2價,處于ⅡA族,原子半徑L>Q,則L為Mg、Q為Be,M只有+3價,處于ⅢA族,原子半徑大于硫,則M為Al元素.
A.水分子之間存在氫鍵,沸點高于硫化氫;
B.氧化鋁能與酸反應生成相應的鹽與水,與堿反應生成相應的鹽與水;
C.金屬性越強,與酸反應越劇烈;
D.核外電子數=質子數-離子帶的電荷.
解答 解:短周期元素,由元素的化合價可知,T、R都有-2價,而R有+6價且原子半徑較大,則T為O元素,R為S元素,L、Q均有+2價,處于ⅡA族,原子半徑L>Q,則L為Mg、Q為Be,M只有+3價,處于ⅢA族,原子半徑大于硫,則M為Al元素.
A.水分子之間存在氫鍵,硫化氫分子之間為范德華力,氫鍵比較范德華力強,故沸點H2O>H2S,故A錯誤;
B.M與T形成的化合物是氧化鋁,是兩性氧化物,故B正確;
C.金屬性Mg比Be強,則Mg與酸反應越劇烈,則相同條件下單質與稀鹽酸反應速率為L>Q,故C錯誤;
D.L2+的核外電子數為12-2=10,R2-的核外電子數為16-(-2)=18,不相等,故D錯誤.
故選B.
點評 本題考查結構性質位置關系應用,利用原子半徑及化合價來推斷出元素是解答本題的關鍵,并熟悉元素及其單質、化合物的性質來解答即可,難度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:解答題
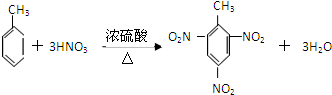 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
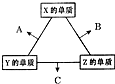 X、Y、Z三種短周期元素,其單質在常溫下均為無色氣體,它們的原子序數之和為16.在適當條件下三種單質兩兩化合,可發生如圖所示變化.己知1個B分子中含有Z元素的原子個數比C分子中含有Z元素的原子個數少1個.請回答下列問題:由 X、Y、Z三種元素共同組成的三種不同種類化合物的化學式為HNO3、NH4NO3、NH3.H2O.
X、Y、Z三種短周期元素,其單質在常溫下均為無色氣體,它們的原子序數之和為16.在適當條件下三種單質兩兩化合,可發生如圖所示變化.己知1個B分子中含有Z元素的原子個數比C分子中含有Z元素的原子個數少1個.請回答下列問題:由 X、Y、Z三種元素共同組成的三種不同種類化合物的化學式為HNO3、NH4NO3、NH3.H2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電解水 | B. | 干冰受熱直接變成氣體 | ||
| C. | HCl溶解于水 | D. | 打雷放電時,O2變成O3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
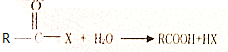
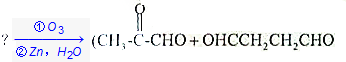

 .
.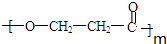 +(m-1)H2O.②B-C、C-E的反應類型分別為:加成反應、縮聚反應.
+(m-1)H2O.②B-C、C-E的反應類型分別為:加成反應、縮聚反應.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 物質 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 開始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 達到平衡時,Ⅰ途徑的反應速率V(A)等于Ⅱ途徑的反應速率V(A) | |
| B. | 達到平衡時,第Ⅰ條途徑混合氣體的密度與第Ⅱ條途徑混合氣體的密度相同 | |
| C. | Ⅰ和Ⅱ兩途徑最終達到平衡時,體系內混合氣體的體積分數相同 | |
| D. | Ⅰ和Ⅱ兩途徑最終達到平衡時,體系內混合氣體的體積分數不同 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③ | B. | ②④ | C. | ②③④ | D. | ①③④ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com