
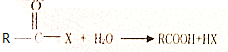
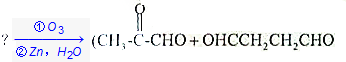

 .
.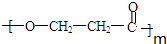 +(m-1)H2O.②B-C、C-E的反應類型分別為:加成反應、縮聚反應.
+(m-1)H2O.②B-C、C-E的反應類型分別為:加成反應、縮聚反應. 分析 (1)根據信息碳碳雙鍵跟臭氧反應,再在鋅粉存在下水解,斷裂出兩端的碳原子各結合一個氧原子而成醛基或酮基,斷裂后的CH2生成甲醛,CH-CH結構生成乙二醛,C(CH3)2結構生成丙酮;
(2)烴1mol與2mol Br2完全加成,則該烴分子有2個雙鍵或1個三鍵,C7H10跟臭氧反應,再在鋅粉存在下水解生成,則產物中醛基的位置為碳碳雙鍵的連接位置;
(3)高分子化合物(C4H5Cl)n跟臭氧反應,再在鋅粉存在下水解,說明A中含有碳碳雙鍵,B能發生銀鏡反應說明含有醛基,B與氫氣加成生成含有醇羥基的C,C在濃硫酸的作用下發生酯化反應生成五元環酯,說明C中還含有羧酸,羧酸與氫氣不加成,說明B中含有羧酸,根據信息羧酸分子中羧基上的羧基被鹵元素原子取代后的生成物交酰鹵,酰鹵極易一水反應,所以高分子化合物(C4H5Cl)n為 ,跟臭氧反應,再在鋅粉存在下水解,B為OHCCH2CH2COOH,與氫氣反應生成C為HOCH2CH2COOH,C發生自身酯化反應,所以E為:
,跟臭氧反應,再在鋅粉存在下水解,B為OHCCH2CH2COOH,與氫氣反應生成C為HOCH2CH2COOH,C發生自身酯化反應,所以E為: ,C發生縮聚反應,所以D
,C發生縮聚反應,所以D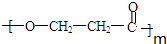 ,據此分析解答.
,據此分析解答.
解答 解:(1)根據信息碳碳雙鍵跟臭氧反應,再在鋅粉存在下水解,斷裂出兩端的碳原子各結合一個氧原子而成醛基或酮基,反應為:CH2=CH-CH=C(CH3)2$→_{②Zn,H_{2}O}^{①O_{3}}$HCHO+OHCCHO+CH3COCH3,
故答案為:CH2=CH-CH=C(CH3)2$→_{②Zn,H_{2}O}^{①O_{3}}$HCHO+OHCCHO+CH3COCH3;
(2)C7H10跟臭氧反應,再在鋅粉存在下水解生成CH3COCHO,OHCCH2CH2CHO,則產物中醛基的位置為碳碳雙鍵的連接位置,C7H10烴1mol與2mol Br2完全加成,則該烴分子有2個雙鍵,7個碳的飽和烴為C7H16,所以C7H10為環烴且有2個雙鍵,所以其結構簡式為: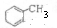 ,
,
故答案為: ;
;
(3)高分子化合物(C4H5Cl)n跟臭氧反應,再在鋅粉存在下水解,說明A中含有碳碳雙鍵,B能發生銀鏡反應說明含有醛基,A→B:(C4H5Cl)n$→_{②Zn,H_{2}O}^{①O_{3}}$OHCCH2CH2COOH+HCl,
B與氫氣加成生成含有醇羥基的C,C在濃硫酸的作用下發生酯化反應生成五元環酯,說明C中還含有羧酸,羧酸與氫氣不加成,說明B中含有羧酸,B→C:OHCCH2CH2COOH+H2$\stackrel{催化劑}{→}$HOCH2CH2COOH,
C在濃硫酸的作用下發生酯化反應生成五元環酯,C→E:HOCH2CH2COOH$→_{△}^{濃硫酸}$ +H2O,C發生縮聚反應:m HOCH2CH2COOH$→_{△}^{催化劑}$
+H2O,C發生縮聚反應:m HOCH2CH2COOH$→_{△}^{催化劑}$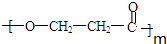 +(m-1)H2O,
+(m-1)H2O,
①根據信息羧酸分子中羧基上的羧基被鹵元素原子取代后的生成物交酰鹵,酰鹵極易一水反應,所以高分子化合物(C4H5Cl)n為[CH2CH=CClCH2]n,C在濃硫酸的作用下發生酯化反應生成五元環酯,C→E:HOCH2CH2COOH$→_{△}^{濃硫酸}$ +H2O,所以E為
+H2O,所以E為 ,
,
故答案為: ;
; ;
;
②B→C發生加成反應,反應為:OHCCH2CH2COOH+H2$\stackrel{催化劑}{→}$HOCH2CH2COOH,
C發生縮聚反應:m HOCH2CH2COOH$→_{△}^{催化劑}$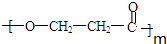 +(m-1)H2O,
+(m-1)H2O,
故答案為:OHCCH2CH2COOH+H2$\stackrel{催化劑}{→}$HOCH2CH2COOH;m HOCH2CH2COOH$→_{△}^{催化劑}$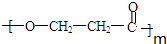 +(m-1)H2O;加成反應;縮聚反應.
+(m-1)H2O;加成反應;縮聚反應.
點評 本題考查有機物推斷,關鍵是根據題中信息及各物質轉化的條件進行物質結構的推斷,題目難度中等,答題時注意根據根據信息碳碳雙鍵跟臭氧反應,再在鋅粉存在下水解轉化關系進行分析判斷.


科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 稀有氣體元素原子的最外層電子數都是8 | |
| B. | 非金屬元素的最外層電子數都大于3 | |
| C. | 金屬元素的最外層電子數不都小于4 | |
| D. | 所有原子核都是由質子和中子構成的 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 元素代號 | L | M | Q | R | T |
| 原子半徑/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合價 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氫化物的沸點為H2T<H2R | |
| B. | M和T形成的化合物既能與強酸反應又能與強堿反應 | |
| C. | 單質與等濃度的稀鹽酸反應的劇烈程度為Q>L | |
| D. | L2+與R2-的核外電子數相等 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | A→B | B. | B→C | C. | C→D | D. | D→E |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{(a+c)}{(a+b)}$ | B. | $\frac{(2c+a)}{(a+b+c)}$ | C. | $\frac{2(a+c)}{(a+2b+c)}$ | D. | $\frac{(2c+a)}{(2b+a)}$ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com