
| A. | 將等體積的①、②溶液混合后,鹽酸會抑制醋酸的電離,所以pH>2 | |
| B. | 將一定體積的②、③溶液混合后,溶液顯堿性,則該混合溶液中c(Cl-)>c(NH4+) | |
| C. | 將一定體積的①、④溶液混合后,溶液顯酸性,則V(NaOH)可能等于V(CH3COOH) | |
| D. | 向等體積的③、④溶液中加水稀釋10倍,稀釋后溶液中由水電離的c(H+):③>④ |
分析 A.根據醋酸的電離平衡CH3COOH?CH3COO-+H+分析;
B.氨水中一水合氨的濃度大于氫氧根離子的濃度;
C.醋酸的濃度大于氫離子濃度,氫氧化鈉的濃度等于氫氧根離子的濃度;
D.稀釋促進氨水的電離,氫氧根離子濃度變化小,氫氧根離子濃度越大,水電離的氫離子濃度越小.
解答 解:A.pH=2的CH3COOH溶液與pH=2的HCl溶液等體積混合,醋酸的濃度減小,電離平衡CH3COOH?CH3COO-+H+向正方向移動,所以氫離子的物質的量增大,則pH小于2,故A錯誤;
B.氨水中一水合氨的濃度大于氫氧根離子的濃度,即c(NH3•H2O)>0.01mol/L,c(HCl)=0.01mol/L,則二者等體積混合時,氨水過量,所以c(Cl-)<c(NH4+),故B錯誤;
C.醋酸的濃度大于氫離子濃度,即c(CH3COOH)>0.01mol/L,氫氧化鈉的濃度等于氫氧根離子的濃度,c(NaOH)=0.01mol/L,所以二者等體積混合時,醋酸過量,溶液顯酸性,故C正確;
D.向等體積的③、④溶液中加水稀釋10倍,稀釋促進氨水的電離,氫氧根離子濃度變化小,所以稀釋后氨水中的氫氧根離子濃度大于氫氧化鈉,氫氧根離子濃度越大,水電離的氫離子濃度越小,即由水電離的c(H+):③<④,故D錯誤.
故選C.
點評 本題考查了弱電解質的電離、溶液稀釋后PH值相對大小的比較等知識點,注意無論是水溶液還是堿溶液都抑制水的電離,鹽類的水解能促進水的電離,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 1mol Na與足量水反應,轉移電子數為NA | |
| B. | 同溫同壓下,相同體積的物質,其物質的量必相等 | |
| C. | 5.3g Na2CO3固體含有的離子數為1.5NA | |
| D. | 標準狀況下,22.4L H2O所含的原子數為3 NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 同時減少 | B. | 同時增大 | C. | v(正)增大,v(逆)減少 | D. | v(正)減少,v(逆)增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 新制的氯水在光照下顏色逐漸變淺 | |
| B. | H2、I2、HI平衡混合氣縮小體積加壓后顏色變深 | |
| C. | 工業上生產硫酸的過程中,SO2在催化氧化時條件控制為常壓,而不是高壓 | |
| D. | 工業上合成氨氣時溫度選擇450℃左右,而不是常溫 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在現實生活中,電化學腐蝕要比化學腐蝕嚴重的多,危害更大 | |
| B. | 用活性炭為糖漿脫色和用臭氧漂白紙漿,原理不同 | |
| C. | 鋼鐵制品和銅制品既能發生吸氧腐蝕又能發生析氫腐蝕 | |
| D. | 在銅的精煉裝置中,通常用粗銅作作陽極,精銅作陰極 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 碳、氮及其化合物在工農業生產生活中有著重要作用.請回答下列問題:
碳、氮及其化合物在工農業生產生活中有著重要作用.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 單質沸點:X>Y | B. | 陽離子的氧化性:W>Y | ||
| C. | 氧化物的水化物的酸性:Z>X | D. | Y、Z的簡單離子均能抑制水的電離 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
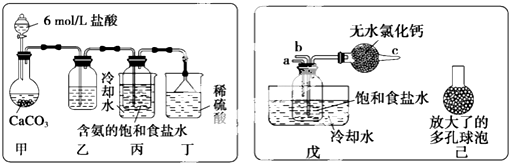
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com