
分析 (1)鐵釘(碳素鋼)放入冷濃硫酸中,濃硫酸有較強的氧化性能使鐵釘鈍化;
(2)①利用+2價亞鐵離子能使酸化的高錳酸鉀褪色來檢驗;
②生成的SO2具有還原性,通入足量溴水中,發生SO2+Br2+2H2O=2HBr+H2SO4,利用硫元素的守恒,結合關系式:SO2→BaSO4求出SO2的體積分數;
(3)Al和水不反應,所以剩余金屬應該是Al,根據Na和Al之間的關系式及轉移電子守恒計算;
(4)固體混合物和稀硫酸反應后有固體剩余,說明溶液中不存在鐵離子,向濾液中加入加入2mol/L的NaOH溶液,加至40mL時開始出現沉淀,說明硫酸有剩余,鐵先和銅離子后和氫離子發生置換反應,所以濾液中的溶質是硫酸、硫酸亞鐵,根據硫酸根離子守恒計算硫酸亞鐵的物質的量濃度.
解答 解:(1)鐵釘(碳素鋼)放入冷濃硫酸中,濃硫酸有較強的氧化性能使鐵釘鈍化阻止反應進一步進行,故答案為:鐵表面被鈍化;
(2)①金屬鐵和硫酸之間發生反應,可能會發生的反應有:Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+;故答案為:Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+;
②SO2具有還原性,通入足量溴水中,發生SO2+Br2+2H2O=2HBr+H2SO4,
n(混合氣體)=$\frac{0.336L}{22.4l/mol}$=0.015mol,
SO2→BaSO4
1mol 233g
n 2.33g
n=0.01mol
則 SO2的體積分數:$\frac{0.01}{0.015}$×100%=66.7%,
故答案為:66.7%.
(3)Al和水不反應,所以剩余金屬應該是Al,反應方程式為2Na+2H2O=2NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,可以得出關系式Na~NaOH~Al,則參與反應的Na和Al的質量之比為23:27,Na和Al的質量和為15g,所以n(Na)=$\frac{\frac{23}{23+27}×15}{23}$mol=0.3mol,n(Al)=$\frac{15×\frac{27}{23+27}}{27}$mol=0.3mol,根據Na、Al和氫氣之間的關系式得氫氣體積=(0.3mol×0.5+0.3mol×1.5)×22.4L/mol=13.44L,
故答案為:13.44;
(4)固體混合物和稀硫酸反應后有固體剩余,說明溶液中不存在鐵離子,向濾液中加入加入2mol/L的NaOH溶液,加至40mL時開始出現沉淀,說明硫酸有剩余,鐵先和銅離子后和氫離子發生置換反應,所以濾液中的溶質是硫酸、硫酸亞鐵,n(H2SO4)=2.2mol/L×0.12L=0.264mol,
與氫氧化鈉反應的硫酸的物質的量為:$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×2mol/L×0.04L=0.04mol,剩余的硫酸的物質的量=0.264mol-0.04mol=0.224mol,
剩余硫酸與固體反應生成了硫酸亞鐵,根據硫酸和硫酸亞鐵的關系式計算硫酸亞鐵的物質的量濃度=$\frac{0.224mol}{0.12L}$=1.87mol/L,
故答案為:1.87.
點評 本題綜合考查元素化合物知識、提出假設并設計實驗方案的能力和文字表達能力,開放性較強,涉及濃硫酸的強氧化性,C、S與Fe及其化合物的性質,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | ⑥⑤②①④③ | B. | ⑤⑥②①③④ | C. | ④③②①⑤⑥ | D. | ④③①②⑥⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題

| A. | 保持溫度和活塞位置不變,在甲中再加入1 mol A和2 mol B,達到新的平衡后,甲中C的濃度是乙中C的濃度的2倍 | |
| B. | 保持活塞位置不變,升高溫度,達到新的平衡后,甲、乙中B的體積分數均減少 | |
| C. | 保持溫度和乙中的壓強不變,t2時分別向甲、乙中加入等質量的氦氣后,甲、乙中反應速率變化情況分別如圖2和圖3所示(t1前的反應速率變化已省略) | |
| D. | 保持溫度不變,移動活塞P,使乙的容積和甲相等,達到新的平衡后,乙中C的體積分數是甲中C 的體積分數的2倍 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
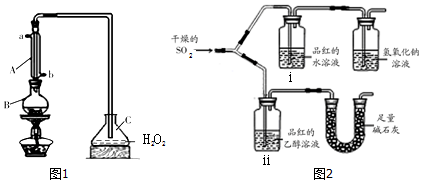
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
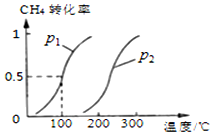 甲烷廣泛存在于天然氣、沼氣、煤礦坑氣之中,是優質的氣體燃料,更是制造許多化工產品的重要原料.
甲烷廣泛存在于天然氣、沼氣、煤礦坑氣之中,是優質的氣體燃料,更是制造許多化工產品的重要原料.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na+、Ba2+、S2-、SO42- | B. | Na+、Cu2+、SO42-、Cl- | ||
| C. | Br-、Ba2+、Cl-、K+ | D. | Ca2+、K+、CO32-、NO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
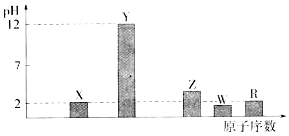
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com