

| A. | Y的原子半徑在同周期主族元素中最大 | |
| B. | W的非金屬性比Z的弱 | |
| C. | Z的氣態氫化物的穩定性在同主族元素中最強 | |
| D. | W的最高價氧化物對應的水化物是強酸 |
分析 根據短周期元素W、X、Y、Z在元素周期表中的位置知,X、Y、Z、W分別是He、F、S、Cl元素,
A、同周期自左而右原子半徑減小;
B、同一周期元素中,元素的非金屬性隨著原子序數的增大而增強;
C、元素的非金屬性越強,其氫化物越穩定;
D、W為Cl,其最高價氧化物對應的水化物高氯酸是強酸.
解答 解:A、同周期自左而右原子半徑減小,Y的原子半徑在同周期主族元素中最小,故A錯誤;
B、同一周期元素中,元素的非金屬性隨著原子序數的增大而增強,所以W的非金屬性比Z的強,故B錯誤;
C、元素的非金屬性越強,其氫化物越穩定,同一主族元素中,Z的非極性不是最強的,所以其氫化物不是最穩定的,故C錯誤;
D、Cl元素最高價氧化物對應的水化物是高氯酸,高氯酸是強酸,故D正確;故選D.
點評 本題考查元素周期表與元素周期律,難度不大,側重對元素周期律的考查,注意整體把握元素周期表的結構.


 提分百分百檢測卷系列答案
提分百分百檢測卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 由水電離出c(H+)=10-3 mol•L-1的溶液中:Na+、AlO2-、NO3-、HCO3- | |
| C. | 無色溶液中可能大量存在Al3+、NH4+、Cl-、S2- | |
| D. | pH=12的溶液:K+、Na+、CH3COO-、Br- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 離子半徑:Al3+>Mg2+>F- | B. | 熱穩定性:HI>HBr>HCl>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 堿性:Al(OH)3>Mg(OH)2>NaOH |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 離子 | 開始沉淀時的pH | 完全沉淀時的pH | 加堿溶解的pH |
| Fe2+ | 7.6 | 9.7 | |
| Fe3+ | 2.7 | 3.7 | |
| Al3+ | 3.8 | 4.7 | >8.5 |
| Mn2+ | 8.3 | 9.8 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
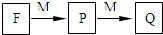 短周期主族元素A、B、C、D、E、F的原子序數依次增大.A和B形成4個原子核的分子,A和C形成3個原子核的分子,且兩種分子均含有10個電子.D的陽離子的電子層結構與氖相同,且與A同主族.E的常見氧化物有兩種,其中一種能使品紅溶液褪色.
短周期主族元素A、B、C、D、E、F的原子序數依次增大.A和B形成4個原子核的分子,A和C形成3個原子核的分子,且兩種分子均含有10個電子.D的陽離子的電子層結構與氖相同,且與A同主族.E的常見氧化物有兩種,其中一種能使品紅溶液褪色.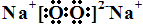 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 物質的量相等的185Hf與180Hf質量相同 | |
| B. | 核外電子數分別為108、113 | |
| C. | 1 mol 180Hf比1 mol 185Hf的中子數少5NA | |
| D. | 180Hf、185Hf在周期表中的位置不同 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com