
 如圖是研究銅與濃硫酸的反應裝置:
如圖是研究銅與濃硫酸的反應裝置:| 資料1 |
| ||||||||||||
| 資料2 | X射線晶體分析表明,銅與濃硫酸反應生成的黑色物質為Cu2S、CuS、Cu7S4中的一種或幾種. |
分析 (1)A裝置中是銅和濃硫酸加熱方式反應生成硫酸銅、二氧化硫和水;
(2)生成的二氧化硫具有漂白性分析,二氧化硫的漂白作用是形成不穩定的無色物質;
(3)飽和氯水和二氧化硫反應,C試管口的棉花是防止二氧化硫、氯氣揮發到空氣中污染空氣,試管C口部的棉團浸有NaOH,可與二氧化硫反應防止污染空氣;
(4)可通過抽動銅絲控制反應,證明A試管中反應所得產物是否含有銅離子的操作方法是利用銅離子在溶液中呈藍色;
(5)圖表數據分析銅和濃硫酸反應過程中會生成黑色物質證明有副反應,濃度合適會避免黑色固體出現,濃度越大,溫度越高黑色越難消失.
解答 解:(1)A裝置中是銅和濃硫酸加熱方式反應生成硫酸銅、二氧化硫和水,反應的化學方程式為:Cu+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案為:Cu+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)生成的二氧化硫具有漂白性,二氧化硫的漂白作用是形成不穩定的無色物質,品紅溶液由紅色變成無色;
故答案為:溶液由紅色變成無色;
(3)飽和氯水和二氧化硫反應,C試管口的棉花是防止二氧化硫、氯氣揮發到空氣中污染空氣,試管C口部的棉團浸有NaOH,可與二氧化硫反應防止污染空氣;
故答案為:吸收Cl2和SO2,防止污染空氣;
(4)可通過抽動銅絲控制反應,證明A試管中反應所得產物是否含有銅離子的操作方法是利用銅離子在溶液中呈藍色,向上拉銅絲,終止反應,冷卻后,將A中溶液慢慢倒入盛有少量水的燒杯(試管)里,觀察溶液顏色是否為藍色證明是否生成銅離子;
故答案為:向上拉銅絲,終止反應,冷卻后,將A中溶液慢慢倒入盛有少量水的燒杯(試管)里,觀察溶液顏色是否為藍色證明是否生成銅離子;
(5)依據圖表數據分析可知,濃度不同時出現黑色物質的時間隨濃度增大減小,濃度為18mol/L時生成的黑色物質不能消失;
a.分析過程可知.發生的反應過程中生成二氧化硫和硫酸銅的反應過程中有奇談反應發生生成黑色物質,銅與濃硫酸反應時所涉及的反應可能不止一個,故a正確;
b.圖表數據可知硫酸濃度選擇適當,小于15mol/L,可避免最后產物中出現黑色物質,故b正確;
c.濃硫酸和銅的反應濃度小于15mol/L也可能出現黑色物質,出現的時間長,該反應發生的條件不一定是硫酸濃度≥15mol•L-1,故c錯誤;
d.圖表數據中,18mol/L的濃硫酸,出現褐色物質的時間短,黑色物質難以消失,所以硫酸濃度越大,黑色物質越快出現、越難消失,故d正確;
故答案為:abd.
點評 本題考查了物質性質實驗方案的設計,題目難度中等,涉及濃硫酸與銅反應、二氧化硫的漂白性、氧化性的實驗驗證、污染氣體的實驗處理、二氧化硫的還原性和酸性氧化物的性質應用等知識,注意掌握濃硫酸的性質、二氧化硫的性質及檢驗方法,(2)為難點,充分考查了學生的分析、理解能力及靈活應用基礎知識的能力.


 53隨堂測系列答案
53隨堂測系列答案科目:高中化學 來源: 題型:解答題
 單質、氧化物、酸、堿和鹽的相互關系,可以用圖簡單表示,限選擇鐵、碳、氧氣、鹽酸、氧化鈣、二氧化碳、水、氫氧化鈣8種物質作為反應物,將圖中指定序號的轉變用化學方程式表示(所寫化學方程式不得重復).
單質、氧化物、酸、堿和鹽的相互關系,可以用圖簡單表示,限選擇鐵、碳、氧氣、鹽酸、氧化鈣、二氧化碳、水、氫氧化鈣8種物質作為反應物,將圖中指定序號的轉變用化學方程式表示(所寫化學方程式不得重復).查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 密閉容器中氣體的平均相對分子質量不變則該反應達到平衡狀態 | |
| B. | 20℃時,氨基甲酸銨的分解平衡常數為2.048×10-9mol3•L-3 | |
| C. | 恒溫下壓縮體積,NH3的體積分數不變 | |
| D. | 再加入一定量氨基甲酸銨,可加快正反應反應速率 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 如圖所示的裝置,C、D、E、F、X、Y都是惰性電極.接通電源后,向乙中滴入酚酞溶液,在F極附近顯紅色.試回答下列問題:
如圖所示的裝置,C、D、E、F、X、Y都是惰性電極.接通電源后,向乙中滴入酚酞溶液,在F極附近顯紅色.試回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 丙烷、丁烯 | B. | 乙炔、丙烷 | C. | 乙烷、乙烯 | D. | 乙炔、乙烯 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
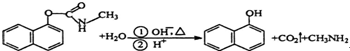
| A. | 西維因是一種芳香烴 | |
| B. | 西維因分子中所有碳原子一定共面 | |
| C. | 可用FeCl3溶液檢驗西維因是否發生水解 | |
| D. | 在Ni催化加熱條件下西維因不能與H2加成 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
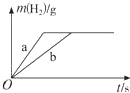
| A. | 曲線a為K,b為Na | |
| B. | 稀鹽酸一定不足量 | |
| C. | 投入Na、K一定等質量 | |
| D. | 投入Na的物質的量小于K的物質的量 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com