
| A. | 負極的電極反應式為2I--2e-═I2 | |
| B. | 正極的電極反應式為AsO43-+2H++2e-?AsO33-+H2O | |
| C. | 利用酸度計(ph計)測定溶液的pH,若溶液的pH不再發生變化,應達到平衡 | |
| D. | 利用該反應設計原電池,利用毫安表測定電池的電流強度,當電池達到最大時,反應達到平衡 |
分析 反應AsO43-+2I-+2H+?AsO33-+I2+H2O 設計成原電池,As元素的化合價降低,I元素的化合價升高,則負極發生的氧化反應2I--2e-═I2,正極發生的還原反應AsO43-+2H++2e-?AsO33-+H2O,以此來解答.
解答 解:A、反應AsO43-+2I-+2H+?AsO33-+I2+H2O 設計成原電池,As元素的化合價降低,I元素的化合價升高,則負極發生的氧化反應2I--2e-═I2,故A正確;
B、應AsO43-+2I-+2H+?AsO33-+I2+H2O 設計成原電池,As元素的化合價降低,I元素的化合價升高,正極發生的還原反應AsO43-+2H++2e-?AsO33-+H2O,故B正確;
C、利用酸度計(ph計)測定溶液的pH,若溶液的pH不再發生變化,即氫離子濃度不再發生變化,此事反應達到平衡,故C正確;
D、利用該反應設計原電池,利用毫安表測定電池的電流強度,電流示數是零時,反應達到平衡,故D錯誤.
故選D.
點評 本題考查原電池,注意利用氧化還原反應來分析發生的電極反應,選項D為解答的難點,題目難度中等.


科目:高中化學 來源: 題型:填空題
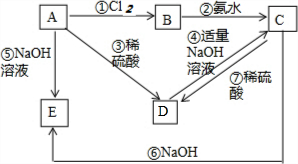 已知金屬A為常見的金屬單質,根據下列物質的轉化關系完成各小題(圖中表示主要物質的轉化關系,反應中生成的水、氣體等物質未標出)
已知金屬A為常見的金屬單質,根據下列物質的轉化關系完成各小題(圖中表示主要物質的轉化關系,反應中生成的水、氣體等物質未標出)查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH3COOH在水中電離:CH3COOH═H++CH3COO- | |
| B. | Na2CO3溶液與足量鹽酸反應:CO32-+H+═HCO3ˉ | |
| C. | 大理石中加入稀鹽酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | MgC12溶液與過量氨水反應:Mg2++2OH-═Mg(OH)2↓ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 200mL 1mol•L-1Fe2(SO4)3溶液中,Fe3+和SO42-離子數的總和是NA | |
| B. | 室溫下,pH=13的NaOH溶液中含OH-數目為NA | |
| C. | 室溫下,1L pH=12的Ba(OH)2溶液中OH-數目為0.2NA | |
| D. | 室溫下,1L pH=1的鹽酸中,由水電離的H+數目為10-13NA |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
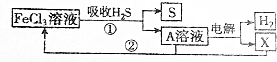
| A. | A溶液中溶質的成分為FeCl2 | B. | X為Cl2并且在陰極上生成的 | ||
| C. | 廢氣中的H2S最終轉化為S和H2 | D. | 只有流程①為氧化還原反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溶質 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.1 | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 已知C2H6的燃燒熱為1090 kJ•mol-1,則C2H6燃燒的熱化學方程式為:C2H6(g)+3.5O2(g)═2CO2(g)+3H2O(g)△H=-1090 kJ/mol | |
| B. | 25℃,101kPa下,l mol C6H6燃燒生成CO2和液態水時放出3260 kJ熱量,其熱化學方程式為:C6H6(g)+7.5O2(g)=6CO2(g)+3H2O (l)△H=-3260kJ•mol-1 | |
| C. | 已知常溫下:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,則稀醋酸與稀NaOH溶液反應生成1 mol H2O(l)時也放出57.3 kJ的熱量 | |
| D. | 已知2CO(g)+O2(g)═2CO2(g)△H=-566 kJ•mol-1,則CO的燃燒熱△H=-283 kJ•mol-1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com