
分析 (1)硫酸氫鈉少量,離子方程式按照硫酸氫鈉的化學式組成書寫,碳酸氫根離子部分反應;
(2)還原性Fe2+>Br-,亞鐵離子優先被氧化,溴離子有1/3的被氧化時,亞鐵離子已經完全被氧化,根據溴化亞鐵的化學式計算出參加反應的亞鐵離子和溴離子的物質的量之比,再計算出反應的化學方程式.
解答 解:(1)少量NaHS04溶液和Ba(HC03)2溶液,反應生成碳酸氫鈉、硫酸鋇沉淀、二氧化碳氣體和水,反應的離子方程式為:H++SO42-+Ba2++HCO3-=BaSO4↓+CO2↑+H2O,
故答案為:H++SO42-+Ba2++HCO3-=BaSO4↓+CO2↑+H2O;
(2)亞鐵離子的還原性大于溴離子,亞鐵離子優先被氧化,有1/3的Br-被氧化,則亞鐵離子完全被氧化,參加反應的亞鐵離子和溴離子的物質的量之比為:1:(2×$\frac{1}{3}$)=3:2,反應的離子方程式為:6Fe2++4Br-+5Cl2═6Fe3++2Br2+10Cl-,
故答案為:6Fe2++4Br-+5Cl2═6Fe3++2Br2+10Cl-.
點評 本題考查了離子方程式的書寫,題目難度中等,注意掌握離子方程式的書寫原則,試題側重考查反應物過量情況對生成物的影響,有利于培養學生靈活應用基礎知識的能力.


 小學課堂作業系列答案
小學課堂作業系列答案 金博士一點全通系列答案
金博士一點全通系列答案科目:高中化學 來源: 題型:解答題
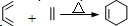
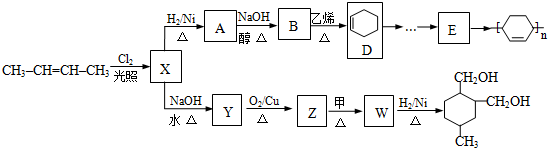
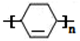
 ;Z→W
;Z→W .
.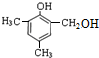 等.
等.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 能被銀氨溶液氧化 | |
| B. | 能使KMnO4酸性溶液褪色 | |
| C. | 1mol該有機物只能與1mol H2發生加成反應 | |
| D. | 1mol該有機物只能與1mol Br2發生加成反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 上述弱酸溶液的pH=4 | |
| B. | 加入NaOH溶液后,弱酸的電離平衡向右移動,K值增大 | |
| C. | 加入等體積0.01 mol•L-1 NaOH溶液后,所得溶液的pH=7 | |
| D. | 加入等體積0.01 mol•L-1 NaOH溶液后,所得溶液的pH<7 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,11.2 L的己烷所含的分子數為0.5 NA 個 | |
| B. | 28 g乙烯所含共用電子對數目為6 NA個 | |
| C. | 標準狀況下,11.2 L二氯甲烷所含分子數為0.5 NA個 | |
| D. | 現有乙烯、丙烯、丁烯的混合氣體共14 g,其原子數為6 NA個 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com