
| 時間(min) 濃度(mol?L-1) | 0 | 5 | 10 | 15 | 20 | 25 |
| NO | 1.00 | 0.60 | 0.40 | 0.40 | 0.52 | 0.52 |
| N2 | 0 | 0.20 | 0.30 | 0.30 | 0.39 | 0.39 |
| CO2 | 0 | 0.20 | 0.30 | 0.30 | 0.39 | 0.39 |
| 23g |
| 46g/mol |
| c(N2)c(CO2) |
| c2(NO) |
| 0.39×0.39 |
| 0.522 |
| 1.0mol/L-0.60mol/L |
| 5min |


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學(xué) 來源: 題型:
| A、甲醛能使蛋白質(zhì)變性,常用高濃度甲醛溶液浸泡食用海產(chǎn)品以防腐 |
| B、硅膠多孔、吸水能力強,常用作袋裝食品的干燥劑 |
| C、過氧化鈉能與二氧化碳反應(yīng)產(chǎn)生氧氣,可用作潛水艇的供氧劑 |
| D、鋅的金屬活潑性比鐵強,可用于保護石油管道(碳素鋼管)以減緩其腐蝕 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
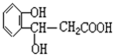 ,能發(fā)生的反應(yīng)類型有( )
,能發(fā)生的反應(yīng)類型有( )| A、①③⑥ | B、①②⑤⑥ |
| C、②③④⑦ | D、除⑤外 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
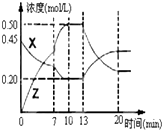 Ⅰ.在1L容器中通入CO2、H2各2mol,在一定條件下發(fā)生反應(yīng):CO2+H2?CO+H2O,
Ⅰ.在1L容器中通入CO2、H2各2mol,在一定條件下發(fā)生反應(yīng):CO2+H2?CO+H2O,查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ? | ? |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com