
分析 (1)化學平衡常數指在一定溫度下,可逆反應達到平衡時,各生成物濃度的化學計量數次冪的乘積除以各反應物濃度的化學計量數次冪的乘積所得的比值,根據元素守恒,故另一反應物為固體C,據此書寫方程式;
(2)①比較反應Ⅰ和Ⅱ,從反應物是否完全轉化比較二者的優(yōu)劣;
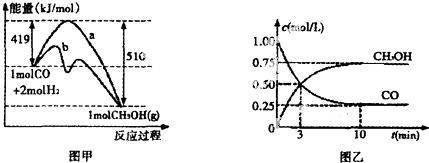
②根據圖象的變化趨勢判斷反應進行的方向和影響因素,依據物質能量變化分析反應熱量變化;圖2分析計算一氧化碳的反應速率,依據反應速率之比等于化學計量數之比計算氫氣表示的反應速率;依據化學平衡三段式列式計算平衡濃度,依據平衡常數概念計算平衡常數;
③依據化學平衡三段式列式計算,平衡氣體物質的量和起始壓強之比等于氣體物質的量之比計算得到;增加甲醇產率,應使平衡正向進行.
解答 解:(1)平衡表達式為:K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$,生成物為CO、H2,反應物含有H2O,三者化學計量數分別為1、1、1,根據元素守恒,故另一反應物為固體C,反應中它所對應反應的化學方程式為:C(s)+H2O(g)?CO(g)+H2(g),
故答案為:C(s)+H2O(g)?CO(g)+H2(g);
(2)①反應I中反應物完全轉化,原子利用率為100%,符合“原子經濟性”的原則,
故答案為:反應Ⅰ符合“原子經濟性”的原則即原子利用率為100%;
②分析圖1可知反應能量變化b圖象是使用催化劑降低反應的活化能,加快反應速率;圖象分析反應物能量高于生成物的能量,反應是放熱反應;圖2分析計算一氧化碳的反應速率v(CO)=$\frac{1.0mol/L-0.25mol/L}{10min}$=0.075mol/L•min,由反應速率之比等于化學計量數之比可知,氫氣表示的反應速率為v(H2)=2v(CO)=0.075mol/L•min×2=0.15mol/L•min,故答案為:b;放熱;0.15mol/L•min;
③對于反應Ⅱ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),在一定溫度時,將1mol CO2年和3mol H2充入一密閉恒容容器中,充分反應達到平衡后,若CO2的轉化率為a,CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol) 1 3 0 0
變化量(mol) a 3a a a
平衡量(mol) 1-a 3-3a a a
則容器內的平衡壓強與起始壓強之比=(1-a+3-3a+a+a):(1+3)=1-$\frac{a}{2}$;
a.由①可知,該反應放熱,升溫,平衡向逆反應方向移動,甲醇產率減小,故錯誤;
b.增加CO2的量,平衡向正反應方向移動,甲醇產率增大,故正確;
c.充入He,使體系總壓強增大,各物質的濃度不變,平衡不移動,故錯誤
d.按原比例再充入CO2和H2,由等效平衡可知平衡正向移動,甲醇產率增大,故正確;
故答案為:1-$\frac{a}{2}$;bd.
點評 本題考查了化學平衡的分析應用,化學反應速率、平衡常數計算應用,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
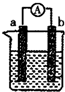 如圖是某化學興趣小組探究不同條件下化學能轉變?yōu)殡娔艿难b置.
如圖是某化學興趣小組探究不同條件下化學能轉變?yōu)殡娔艿难b置.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
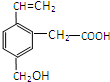 某有機物的結構如圖所示,這種有機物不可能具有的性質是
某有機物的結構如圖所示,這種有機物不可能具有的性質是| A. | ①④ | B. | 只有⑥ | C. | 只有③ | D. | ④⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| X | |||
| Y | Z | R | |
| W |
| A. | 五種元素的原子最外層電子數一定都大于 2 | |
| B. | Y 單質一定既能與鹽酸又能與氫氧化鈉溶液反應 | |
| C. | R 的最高價氧化物對應的水化物一定是強酸 | |
| D. | 若 Z 位于第ⅣA 族,則 Z 的氧化物與 Y 的氧化物中化學鍵類型相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 相同 | B. | 中和HCl的多 | C. | 中和CH3COOH的多 | D. | 無法比較 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 (1)18電子分子中含有4個原子,其結構式是H-O-O-H或PH3
(1)18電子分子中含有4個原子,其結構式是H-O-O-H或PH3查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1mol Na2O2固體中含有的陰離子數為2NA | |
| B. | 常溫常壓下,3.2g CH4中含有的電子數為2NA | |
| C. | 標準狀況下,11.2L乙酸乙酯中含有的分子數為0.5NA | |
| D. | 100mL 1mol•L-1 CH3COOH溶液中含有的CH3COOH分子數為0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 25℃時,pH=13的1.0LBa(OH)2溶液中含有的OH-數目為0.2NA | |
| B. | 標準狀況下,2.24L乙烷中含有的極性鍵數目為0.6NA | |
| C. | 室溫下,3g甲醛和乙酸的混合物中含有的原子數目為0.8NA | |
| D. | 56g鐵與足量稀硫酸反應轉移的電子數為3NA |
查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com