
| A. | 向沸水中滴加飽和FeCl3溶液制備Fe(OH)3膠體:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ | |
| B. | Fe(OH)3溶于氫碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 用小蘇打治療胃酸過多:HCO3-+H+═CO2↑+H2O | |
| D. | 用Pt電極電解飽和氯化鎂溶液:2Cl-+2H2$\frac{\underline{\;電解\;}}{\;}$2OH-+H2↑+Cl2↑ |
分析 A.水解生成膠體,而不是沉淀;
B.發生氧化還原反應生成碘化亞鐵、碘和水;
C.反應生成氯化鈉、水、二氧化碳;
D.生成氫氧化鎂、氫氣、氯氣.
解答 解:A.向沸水中滴加飽和FeCl3溶液制備Fe(OH)3膠體的離子反應為Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(膠體)+3H+,故A錯誤;
B.Fe(OH)3溶于氫碘酸的離子反應為2Fe(OH)3+2I-+6H+═2Fe2++I2+6H2O,故B錯誤;
C.用小蘇打治療胃酸過多的離子反應為HCO3-+H+═CO2↑+H2O,故C正確;
D.用Pt電極電解飽和氯化鎂溶液的離子反應為Mg2++2Cl-+2H2O$\frac{\underline{\;電解\;}}{\;}$Mg(OH)2↓+H2↑+Cl2↑,故D錯誤;
故選C.
點評 本題考查離子反應方程式書寫的正誤判斷,為高頻考點,把握發生的反應及離子反應的書寫方法為解答的關鍵,側重水解、氧化還原反應及電解反應的離子反應考查,綜合性較強,題目難度不大,注意離子反應中保留化學式的物質.


科目:高中化學 來源: 題型:多選題
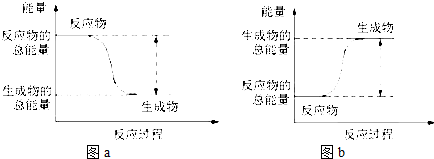
| A. | 圖a表示的是吸熱反應的能量變化 | |
| B. | 圖b中反應物比生成物穩定 | |
| C. | 圖b可以表示氯化銨固體與氫氧化鋇晶體反應的能量變化 | |
| D. | 圖a不需要加熱就一定能發生,圖b一定需要加熱才能發生 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
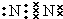 ,雷電作用能進行氮的固定,寫出反應方程式N2+O2$\frac{\underline{\;放電\;}}{\;}$2NO.
,雷電作用能進行氮的固定,寫出反應方程式N2+O2$\frac{\underline{\;放電\;}}{\;}$2NO.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Z、W是金屬元素 | |
| B. | 原子半徑:r(R)<r(W)<r(Z) | |
| C. | Y與Z形成的化合物只有一種 | |
| D. | X、Z、R的最高價氧化物對應的水化物之間都能相互發生反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1mol•L-1的Na2CO3溶液中粒子濃度關系:c(Na+)═2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| B. | 常溫下,氫氧化鈉溶液中滴入醋酸使溶液的pH=7,則混合溶液中醋酸已過量 | |
| C. | 0.2mol•L-1的HCl和0.1 mol•L-1的NH3•H2O等體積混合后溶液中的離子濃度關系:c(Cl-)>c (NH4+)>c(H+)>c (OH-) | |
| D. | 0.1mol•L-1的NaHS溶液中離子濃度關系:c(S2-)+c(OH-)═c(H+)+c(H2S) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 凡金屬元素與非金屬元素化合時都能形成離子鍵 | |
| B. | 非金屬原子間不可能形成離子鍵 | |
| C. | 鈉原子與氯原子通過得失電子,以離子鍵結合成氯化鈉后體系能量降低 | |
| D. | 含有共價鍵的化合物一定是共價化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 元素的相對原子質量的遞增 | |
| B. | 元素的原子半徑呈周期性變化 | |
| C. | 元素原子的最外層電子排布呈周期性變化 | |
| D. | 元素的金屬性和非金屬性呈周期性變化 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com