

分析 酸性條件下硝酸根離子具有氧化性,可氧化海綿銅(主要成分是Cu和少量CuO)生成硫酸銅,過濾后在濾液中加入亞硫酸銨發生氧化還原反應生成CuCl,發生反應:2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+,得到的CuCl經硫酸酸洗,水洗后再用乙醇洗滌,烘干得到氯化亞銅,
(1)濃硫酸的物質的量濃度c=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,設需要濃硫酸的體積為V,根據稀釋定律,稀釋前后溶質物質的量相等;
(2)溶解溫度應控制在60-70℃,原因是溫度低溶解速度慢,溫度過高銨鹽分解;
(3)操作X為過濾操作,用于分離固體和液體;
(4)由流程圖結合氧化還原反應可知亞硫酸銨、氯化銨、硫酸銅和水反應生成硫酸銨、氯化亞銅和硫酸;
(5)生成的氯化亞銅可溶解于氯化銨溶液中.
解答 解:酸性條件下硝酸根離子具有氧化性,可氧化海綿銅(主要成分是Cu和少量CuO)生成硫酸銅,過濾后在濾液中加入亞硫酸銨發生氧化還原反應生成CuCl,發生反應:2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+,得到的CuCl經硫酸酸洗,水洗后再用乙醇洗滌,烘干得到氯化亞銅,
(1)濃硫酸的物質的量濃度c=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,設需要濃硫酸的體積為V,根據稀釋定律,稀釋前后溶質物質的量相等,則:V×18.4mol/L=1000mL×0.25mol•L-1;
解得:V=13.6mL;
故答案為:13.6;
(2)酸性條件下硝酸根離子具有氧化性,可氧化Cu生成Cu2+,溶解溫度應控制在60-70℃,原因是溫度低溶解速度慢,溫度過高銨鹽分解;
故答案為:溫度低溶解速度慢、溫度過高銨鹽分解;
(3)操作X為過濾操作,用于分離固體和液體,故答案為:過濾;
(4)由流程圖結合氧化還原反應可知亞硫酸銨、氯化銨、硫酸銅和水反應生成硫酸銨、氯化亞銅和硫酸;化學方程式為:(NH4)2SO3+2CuSO4+2NH4Cl+H2O=2(NH4)2SO4+2CuCl↓+H2SO4,亞硫酸銨要適當過量,可以提高Cu2+的還原速率,同時可以防止生成Cu+被空氣氧化;
故答案為:(NH4)2SO3+2CuSO4+2NH4Cl+H2O=2(NH4)2SO4+2CuCl↓+H2SO4;提高Cu2+的還原速率,同時可以防止生成Cu+被空氣氧化;
(5)當氯化銨用量增加到一定程度后氯化亞銅的沉淀率減少,原因是生成的氯化亞銅又溶解于氯化銨溶液中,發生CuCl+Cl-=CuCl2-,
故答案為:CuCl+Cl-=CuCl2-.
點評 本題考查物質的制備實驗,為高頻考點,側重于學生的分析能力、實驗能力的考查,注意把握物質的性質以及反應流程,題目難度中等,注意習題中信息應用.


 初中學業考試導與練系列答案
初中學業考試導與練系列答案科目:高中化學 來源: 題型:選擇題
| A. | NaOH可用于治療胃酸過多 | |
| B. | CaO可防止月餅等食品氧化變質 | |
| C. | 氫彈中用到的2H、3H互為同位素 | |
| D. | 向海水中加入凈水劑明礬可以使海水淡化 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
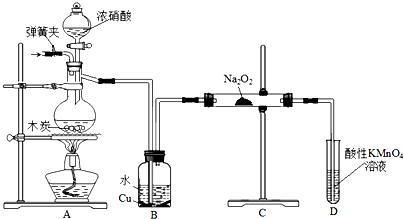
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 已知A、B、C、D是中學化學中常見的四種不同粒子,它們之間存在如圖所示的轉化關系(反應條件已經略去):
已知A、B、C、D是中學化學中常見的四種不同粒子,它們之間存在如圖所示的轉化關系(反應條件已經略去): ;D
;D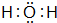 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
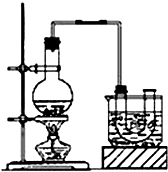 已知:CH3CH2OH+NaBr+H2SO4(濃)$\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.
已知:CH3CH2OH+NaBr+H2SO4(濃)$\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 6.4g | B. | 6g | C. | 12.4g | D. | 8.8g |
查看答案和解析>>
科目:高中化學 來源:2016-2017學年浙江省高一上10月月考化學試卷(解析版) 題型:填空題
汽車常裝有安全氣囊,當發生強烈碰撞時,瞬間引發以下反應:2NaN3=2Na+3N2↑,所產生的氣體快速充滿氣囊,可以達到保護車內人員的目的.
(1)若氣囊中裝有130g NaN3,則其物質的量是_______________.
(2)若130g NaN3完全分解,在標準狀況下,氣囊膨脹的體積約為_______________.
(3)該反應中的氧化劑是 氧化產物是__________
查看答案和解析>>
科目:高中化學 來源:2016-2017學年天津市高一上9月調研化學試卷(解析版) 題型:實驗題
(1)選擇儀器。完成本實驗所必需的儀器有:托盤天平 藥匙、燒杯、玻璃棒、____________、____________以及等質量的兩片濾紙。
(2)計算。配制該溶液需取NaCl晶體____________g。
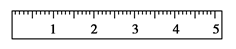
(3)稱量。天平調平之后,應將天平的游碼調至某個位置,請在下圖中用一根 豎線標出游碼左邊緣所處的位置:
(4)將藥品倒入燒杯中溶解、冷卻。
(5)轉移、洗滌。在轉移時應使用玻璃棒引流,需要洗滌燒杯和玻璃棒2~3次是為了_____________
(6)定容、搖勻。
(7)將配好的溶液倒入指定的試劑瓶,并貼好標簽,注明溶液名稱及濃度。
(8)配制時下列操作會導致所配溶液濃度偏高的是________。
A.轉移時有少量溶液濺出 | B.容量瓶用蒸餾水洗凈后未干燥 |
C.定容時俯視讀取刻度 | D.定容時液面超過了刻度線 |
E.稱量NaCl時用了生銹的砝碼
(9)下圖是某同學在實驗室配制該NaCl溶液的過程示意圖,其中有錯誤的是_________(填操作序號)。
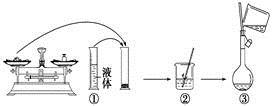
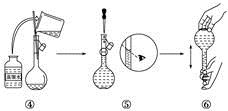
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com