
| 物質 | CO | H2 | CH3OH |
| 濃度(mol•L-1) | 0.9 | 1.0 | 0.6 |
分析 (1)可逆反應到達平衡時,同種物質的正逆速率相等且保持不變,各組分的濃度、含量保持不變,由此衍生的其它一些量不變,判斷平衡的物理量應隨反應進行發生變化,該物理量由變化到不再變化說明到達平衡;
(2)①根據K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$計算平衡常數;
②降低溫度,K值增大,說明降低溫度平衡向正向移動,正向是放熱反應;
③計算濃度商Qc,若Qc=K,處于平衡狀態,若Qc<K,反應向正反應進行,若Qc>K,反應向逆反應進行,進而判斷v正、v逆相對大小.
解答 解:(1)a.該反應兩邊的化學計量數不相等,在反應沒有達到平衡時,氣體的物質的量會發生改變,體系的壓強也要改變,如果壓強不變說明氣體的生成和消耗速率相等,反應達到了平衡,故a正確;
b.反應中NO2是有色氣體,顏色不變說明NO2的濃度不再改變,則反應達到了平衡,故b正確;
c.NO和O2的起始物質的量相等,但化學計量數不同,變化量就不相同,如果沒有達到平衡,NO和O2 的物質的量之比會發生改變,不發生改變說明到達了平衡,故c正確;
d. O2 是反應物,NO2是生成物,不管在任何時候都有每消耗1 molO2同時生成2 molNO2,故d錯誤,
故選:abc;
(2)①平衡常數K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{0.6}{0.9×{1}^{2}}$=$\frac{2}{3}$,故答案為:$\frac{2}{3}$;
②降低溫度,K值增大,說明降低溫度平衡向正向移動,正向是放熱反應,故△H<0,故答案為:<;
③濃度商Qc=$\frac{0.6+\frac{0.4}{2}}{(0.9+\frac{0.6}{2})×{1}^{2}}$=$\frac{2}{3}$=K,處于平衡狀態,則v正=v逆,故答案為:=.
點評 本題考查化學平衡狀態的判斷、平衡常數的計算與應用等,注意判斷平衡的物理量應隨反應進行發生變化,該物理量由變化到不再變化說明到達平衡.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | Al→[Al(OH)4]- | B. | Na2CO3→NaOH | C. | Al2O3→Al(OH)3 | D. | Fe(OH)2→Fe(OH)3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
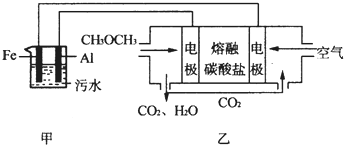
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 熱穩定性:Na2CO3>NaHCO3 | B. | 酸性:H2CO3>H2SiO3 | ||
| C. | 堿性:NaOH>LiOH | D. | 熱穩定性:HF>HBr |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 可用電解熔融CeO2制取金屬鈰,鈰在陽極生成 | |
| B. | 58138Ce、58142Ce是同素異形體 | |
| C. | 鈰能溶于HI溶液,發生反應的離子方程式為:Ce+4H+═Ce4++2H2 | |
| D. | 鈰的原子核外有58個電子 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
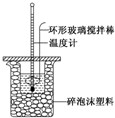 某實驗小組用0.50mol•L-1 NaOH溶液和0.50mol•L-1 硫酸溶液進行反應熱的測定,實驗裝置如圖所示.
某實驗小組用0.50mol•L-1 NaOH溶液和0.50mol•L-1 硫酸溶液進行反應熱的測定,實驗裝置如圖所示.| 溫度 次數 | 起始溫度t1/℃ | 終止溫 度t2/℃ | 溫度差 平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
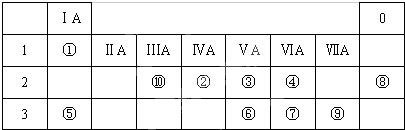
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Mg(OH)2[Al(OH)3] | B. | MgCl2(AlCl3) | C. | Mg(Al) | D. | MgO(Al2O3) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com