


| 1000a |
| 46 |
| V |
| 22.4 |
| 1000a |
| 46 |
| V |
| 22.4 |


 名校練考卷期末沖刺卷系列答案
名校練考卷期末沖刺卷系列答案科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、34S原子核內中子數為16 |
| B、1H216O和1H218O的相對分子質量相差2 |
| C、13C和15N原子的原子序數相差2 |
| D、2H+結合OH-的能力比1H+的更強 |
查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
 某學生利用如圖裝置探究氯氣與氨氣之間的反應.其中A、F分別為氨氣和氯氣的發生裝置,C為純凈干燥的氯氣與氨氣反應的裝置.
某學生利用如圖裝置探究氯氣與氨氣之間的反應.其中A、F分別為氨氣和氯氣的發生裝置,C為純凈干燥的氯氣與氨氣反應的裝置.查看答案和解析>>
科目:高中化學 來源: 題型:

| 實驗編號 | 反應物 | 催化劑 |
| ① | 10mL 2% H2O2溶液 | 無 |
| ② | 10mL 5% H2O2溶液 | 無 |
| ③ | 10mL 5% H2O2溶液 | 0.1gMnO2粉末 |
| ④ | 10mL 5% H2O2溶液+少量HCl溶液 | 0.1gMnO2粉末 |
| ⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 0.1gMnO2粉末 |

| 第一次 | 第二次 | 第三次 | 第四次 | |
| 體積(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
查看答案和解析>>
科目:高中化學 來源: 題型:
 (I)如圖是某學校林老師制備NH3并進行性質實驗時的改進裝置.按圖1把儀器安裝好,稱取2g固體氯化銨裝入試管底部,再稱取2g氫氧化鈉覆蓋在氯化銨上方;立即用帶有滴管的塞子塞緊(滴管預先吸入約2mL濃氨水);燒杯內盛滴有酚酞試液的水:把濃氨水滴入試管里,可立即觀察到試管內發生劇烈反應,有大量氣泡.
(I)如圖是某學校林老師制備NH3并進行性質實驗時的改進裝置.按圖1把儀器安裝好,稱取2g固體氯化銨裝入試管底部,再稱取2g氫氧化鈉覆蓋在氯化銨上方;立即用帶有滴管的塞子塞緊(滴管預先吸入約2mL濃氨水);燒杯內盛滴有酚酞試液的水:把濃氨水滴入試管里,可立即觀察到試管內發生劇烈反應,有大量氣泡.查看答案和解析>>
科目:高中化學 來源: 題型:
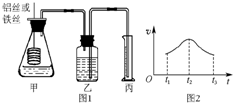 某研究小組擬用定量的方法測量Al和Fe分別與酸反應的快慢,設計了如下圖1所示的裝置.
某研究小組擬用定量的方法測量Al和Fe分別與酸反應的快慢,設計了如下圖1所示的裝置.查看答案和解析>>
科目:高中化學 來源: 題型:
| A、Zn、Ag |
| B、Cu、Fe |
| C、Al、Fe |
| D、Mg、Al |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com