
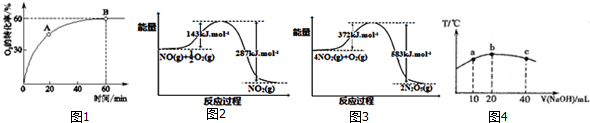
 分析圖象回答:曲線②NO轉化率隨溫度升高而增大的原因反應沒有達到平衡,溫度越高反應速率越快,轉化率越大.在圖2中畫出反應2NO(g)+2CO(g)?N2(g)+2CO2(g)在不同溫度下達到平衡時c(N2)的變化趨勢圖.
分析圖象回答:曲線②NO轉化率隨溫度升高而增大的原因反應沒有達到平衡,溫度越高反應速率越快,轉化率越大.在圖2中畫出反應2NO(g)+2CO(g)?N2(g)+2CO2(g)在不同溫度下達到平衡時c(N2)的變化趨勢圖.分析 (1)根據“SCl2與氨完全反應生成A和淡黃色單質B及離子化合物X,且X的水溶液的pH<7、A隔絕空氣加強熱可得到 B和氣體單質C”知B是S,A含N、S元素,C是氮氣,X是氯化銨.n(A)=$\frac{18.4g}{184g/mol}$=0.1mol,n(S)=$\frac{12.8g}{32g/mol}$=0.4mol,則A中含N:$\frac{(18.4-0.4×32)g}{14g/mol}$=0.4mol,故A的分子式為S4N4,根據原子守恒可書寫出反應方程式;
(2)依據反應自發進行的條件是△H-T△S<0分析判斷;
(3)①N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
②2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
③C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
根據蓋斯定律③×2-①-②計算;
(4)根據2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.5kJ•mol-1,則升高溫度,平衡向逆反應方向移動,所以NO的轉化率應該減小,而曲線②NO轉化率隨溫度升高而增大說明反應沒有達到平衡,溫度越高反應速率越快,轉化率越大,據此分析;
(5)根據HNO2?H++NO2-結合電離常數K=4.6×10-4計算.
解答 解:(1)因為“SCl2與氨完全反應生成A和淡黃色單質B及離子化合物X,且X的水溶液的pH<7、A隔絕空氣加強熱可得到 B和氣體單質C”知B是S,A含N、S元素,C是氮氣,X是氯化銨.n(A)=$\frac{18.4g}{184g/mol}$=0.1mol,n(S)=$\frac{12.8g}{32g/mol}$=0.4mol,則A中含N:$\frac{(18.4-0.4×32)g}{14g/mol}$=0.4mol,故A的分子式為S4N4,所以SCl2與氨反應生成A和淡黃色單質B及離子化合物X,反應方程式:6SCl2+16NH3=S4N4+2S+12NH4Cl,
故答案為:6SCl2+16NH3=S4N4+2S+12NH4Cl;
(2)因為C不完全燃燒時產生CO為放熱反應,則2CO(g)=2C(s)+O2(g)△H>0,又熵變減小的反應,△H>0,△S<0,則△H-T△S>0,反應任何溫度下都不能自發進行;故答案為:不可行,因為△H>0,△S<0,在任何情況下都不能自發進行;
(3)①N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
②2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
③C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
根據蓋斯定律③×2-①-②得2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-393.5×2-180.5+221.0=-746.5kJ•mol-1,故答案為:-746.5kJ•mol-1;
(4)根據(3)2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.5kJ•mol-1,則升高溫度,平衡向逆反應方向移動,所以NO的轉化率應該減小,而曲線②NO轉化率隨溫度升高而增大說明反應沒有達到平衡,溫度越高反應速率越快,轉化率越大;
又2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.5kJ•mol-1,則升高溫度,平衡向逆反應方向移動,所以溫度越高,平衡時c(N2)越小,則變化趨勢圖為 ,故答案為:反應沒有達到平衡,溫度越高反應速率越快,轉化率越大;
,故答案為:反應沒有達到平衡,溫度越高反應速率越快,轉化率越大; .
.
(5)因為HNO2的電離方程式為HNO2?H++NO2-,又電離常數K=4.6×10-4,所以K=$\frac{c(H{\;}^{+})c(NO{\;}_{2}{\;}^{-})}{c(HNO{\;}_{2})}$=$\frac{c{\;}^{2}(H{\;}^{+})}{0.01mol/L}$=4.6×10-4,解得:c(H+)=2.14×10-3mol•L-1,故答案為:2.14×10-3.
點評 本題考查較為綜合,涉及化學方程式書寫、蓋斯定律應用、影響平衡移動的因素以及平衡常數的計算等知識,是高考的熱點題型,解題時利用蓋斯定律求反應熱注意方程式變形時,△H的符號和數值,注意影響化學平衡的因素高頻考點,題目難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mg(OH)2 | |
| 開始沉淀時 | 3.8 | 5.8 | 2.2 | 10.6 |
| 完全沉淀時 | 4.7 | 8.3 | 4.0 | 12 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
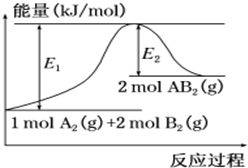 已知某化學反應A2 (g)+2B2 (g)═2AB2(g) (AB2的分子結構為B-A-B)的能量變化如圖所示,下列有關敘述中正確的是( )
已知某化學反應A2 (g)+2B2 (g)═2AB2(g) (AB2的分子結構為B-A-B)的能量變化如圖所示,下列有關敘述中正確的是( )| A. | 該反應的進行一定需要加熱 | |
| B. | 該反應的△H=-(E1-E2)kJ/mol | |
| C. | 該反應中反應物的鍵能總和大于生成物的鍵能總和 | |
| D. | 斷裂1 mol A-A和2 mol B-B放出E1 kJ能量 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 對CO(g)+H2S(g)?COS(g)+H2(g)達到平衡后,升高溫度,H2S濃度增加,表明該反應是吸熱反應 | |
| B. | 對CO(g)+H2S(g)?COS(g)+H2(g)達到平衡后,通入CO后,正反應速率逐漸增大 | |
| C. | 一定條件下反應N2+3H2?2NH3達到平衡時,3v正(H2)=2v逆(NH3) | |
| D. | 對于反應CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,只改變壓強,平衡不發生移動,反應放出的熱量不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 吸收y mol H2只需1 mol MHx | |
| B. | 平衡時容器內氣體壓強減小 | |
| C. | 若降溫,該反應的平衡常數增大 | |
| D. | 若向容器內通入少量氫氣,則v(放氫)>v(吸氫) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將飽和FeCl3溶液滴加入冷水中直接就能制得Fe(OH)3膠體 | |
| B. | 膠體區別于其它分散系的本質特征是膠體粒子的直徑大小 | |
| C. | 用過濾的方法可以分離和提純膠體 | |
| D. | 煮雞蛋的過程中發生了膠體的電泳現象 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com