


分析 CO的制備方法:HCOOH$→_{△}^{濃硫酸}$CO↑+H2O,在題給裝置中,導管a平衡分液漏斗內壓強,使分液漏斗內的液體濃硫酸順利滴下,b主要是起安全瓶的作用,以防止倒吸;c為除去CO中的酸性氣體,選用NaOH溶液,還需用濃硫酸除去CO中的H2O,
(1)①根據裝置圖可知e的名稱;
②為了使產生的氣體能順利的從發生裝置中排出,就必需保持壓強一致,因此a的作用是保持恒壓;
(2)甲酸在濃硫酸作用下脫水生成CO,根據元素守恒和元素守恒可書寫化學方程式;
(3)要檢驗CO中少量S02、C02氣體,用品紅檢驗二氧化硫,并用酸性高錳酸鉀除去二氧化硫,再用品紅檢驗是否除盡,用石灰水檢驗二氧化碳,所以E1中裝置品紅溶液,E2中裝置酸性高錳酸鉀溶液,E3中裝品紅溶液,F中裝澄清石灰水;
(4)題給合成正丁醛的反應為氣體體積減小的放熱反應,為增大反應速率和提高原料氣的轉化率;
(5)根據題中物質提純的流程,粗品中含有正丁醛,利用信息①可知飽和NaHSO3溶液形成沉淀,然后通過過濾即可除去;加入乙醚的目的是萃取溶液中的1-丁醇,1-丁醇和乙醚的沸點相差很大,因此可以利用蒸餾將其分離開.
解答 解:CO的制備方法:HCOOH$→_{△}^{濃硫酸}$CO↑+H2O,在題給裝置中,導管a平衡分液漏斗內壓強,使分液漏斗內的液體濃硫酸順利滴下,b主要是起安全瓶的作用,以防止倒吸;c為除去CO中的酸性氣體,選用NaOH溶液,還需用濃硫酸除去CO中的H2O,
(1)①根據裝置圖可知e的名稱是分液漏斗,
故答案為:分液漏斗;
②為了使產生的氣體能順利的從發生裝置中排出,就必需保持壓強一致,因此a的作用是保持恒壓,
故答案為:平衡內外壓強,保證液體順暢流下;
(2)甲酸在濃硫酸作用下脫水生成CO,反應的化學方程式為HCOOH$→_{△}^{濃硫酸}$CO↑+H2O,
故答案為:HCOOH$→_{△}^{濃硫酸}$CO↑+H2O;
(3)要檢驗CO中少量S02、C02氣體,用品紅檢驗二氧化硫,并用酸性高錳酸鉀除去二氧化硫,再用品紅檢驗是否除盡,用石灰水檢驗二氧化碳,所以E1中裝置品紅溶液,E2中裝置酸性高錳酸鉀溶液,E3中裝品紅溶液,F中裝澄清石灰水,
①根據上面的分析可知,E1的作用是:檢驗產物是否有S02,E3的作用是檢驗S02是否除盡,
故答案為:檢驗產物是否有S02;檢驗S02是否除盡;
②判斷產物中有CO2的現象是E3中品紅不褪色,F中石灰水變渾濁,
故答案為:E3中品紅不褪色,F中石灰水變渾濁;
(4)由于反應是一個體積減小的可逆反應,所以采用高壓,有利于增大反應速率和提高原料氣的轉化率;正向反應是放熱反應,雖然低溫有利于提高原料氣的轉化率,但不利于增大反應速率,因此要采用適當的溫度;催化劑不能提高原料氣的轉化率,但有利于增大反應速率,縮短到達平衡所需要的時間,故正確所選項是D,
故答案為:D;
(5)粗品中含有正丁醛,根據所給的信息利用飽和NaHSO3溶液形成沉淀,然后通過過濾即可除去;由于飽和NaHSO3溶液是過量的,所以加入乙醚的目的是萃取溶液中的1-丁醇;因為1-丁醇和乙醚的沸點相差很大,因此可以利用蒸餾將其分離開,
故答案為:飽和NaHSO3溶液;萃取;蒸餾.
點評 本題考查了氣體的制備、有機物的分離、提純方法、醇的性質以及對基礎知識和基本操作的考查,答題時注意把握基礎知識和基本實驗操作的靈活運用,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 乙烯、植物油和苯都能與氫氣發生加成反應,是因為其結構中都含有碳碳雙鍵 | |
| B. | 開發核能、太陽能等新能源,推廣甲醇汽油,使用無磷洗滌劑都可直接降低碳排放 | |
| C. | 紅外光譜儀、核磁共振儀、質譜儀都可用于有機化合物結構的分析 | |
| D. | 制造玻璃是復雜的物理變化,玻璃的組成不同,性能不同 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | (2a-1.6)g | B. | 2(a-1.6)g | C. | (a-1.6)g | D. | 3.2g |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氫氣的燃燒熱為285.5KJ/mol,則電解水的熱化學方程式為2H2O(l)$\frac{\underline{\;電解\;}}{\;}$ 2H2(g)+O2(g)△H=+285.5KJ/mol | |
| B. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3KJ/mol 則稀H2SO4溶液和稀Ba(OH)2溶液反應的反應熱△H=2×(-57.3)KJ/mol | |
| C. | 在CO2中,Mg燃燒生成MgO和C,該反應中化學能全都轉化為熱能 | |
| D. | 已知AX3的熔點和沸點分別為一93.6℃和76℃,AX5的熔點為167℃.室溫時AX3與氣體X2反應生成1 mol AX5,放出熱量123.8 KJ/mol.該反應的熱化學方程式為AX3(l)+X2(g)═AX5(s)△H=一123.8 KJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
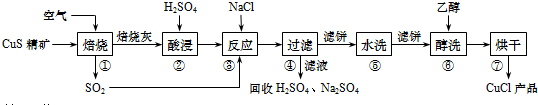
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
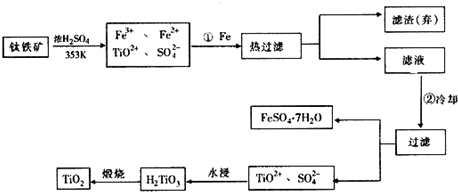
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 元素A的氫化物比元素B的氫化物更穩定 | |
| B. | 元素C、D、E的最高價氧化物對應的水化物兩兩之間能發生反應 | |
| C. | 原子半徑:C>D>B | |
| D. | 元素B的氣態氫化物的沸點比元素E氣態氫化物的沸點高 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com