
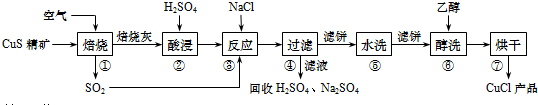
分析 CuS精礦在空氣中焙燒生成氧化銅和二氧化硫,用硫酸酸浸,氧化銅與硫酸反應生成硫酸銅,在硫酸銅溶液加入氯化鈉再通入二氧化硫,生成氯化亞銅和硫酸銅、硫酸,過濾后濾液回收,氯化亞銅經水洗、醇洗、干燥得CuCl產品,
(1)步驟②中主要反應是氧化銅與硫酸反應生成硫酸銅和水,根據電荷守恒和元素守恒書寫離子方程式;
(2)步驟③先加NaCl,氯離子濃度較大,產生的氯化亞銅能溶于氯離子濃度較大的體系,難溶于水,所以加水稀釋就產生大量白色沉淀;
(3)氯化亞銅能溶于氯離子濃度較大的體系,所以酸洗只能用硫酸不能用鹽酸,用乙醇洗滌能快速去除CuCl表面的水分,防止其水解氧化;
(4)反應①S(s)+O2(g)═SO2(g)△H=-296.8 kJ/mol,②2Cu(s)+O2(g)═2CuO(s)△H=-314.6 kJ/mol,③Cu(s)+S(s)═CuS(s)△H=-53.1 kJ/mol,根據蓋斯定律,將①×2+②-③×2可得CuS與O2反應的熱化學方程式;
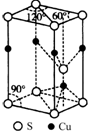
(5)根據均攤法,位于60°角頂點的原子屬于該晶胞的為$\frac{1}{12}$,位于120°角頂點的原子屬于該晶胞的為$\frac{1}{6}$,根據CuS晶胞結構圖可知,還有一個硫原子位于晶胞體內,據此答題;
(6)根據④~⑦步操作共損失產品3.5%可知,生產100 kg 96.5%的CuCl,則反應③中產生的CuCl的質量為$\frac{100Kg×96.5%}{1-3.5%}$=100 kg,根據反應2CuS+3O2═2CuO+2SO2、2CuO+SO2+2NaCl=2CuCl+Na2SO4,可知每生成1molCuCl,會產生1mol二氧化硫需要處理,據此計算.
解答 解:CuS精礦在空氣中焙燒生成氧化銅和二氧化硫,用硫酸酸浸,氧化銅與硫酸反應生成硫酸銅,在硫酸銅溶液加入氯化鈉再通入二氧化硫,生成氯化亞銅和硫酸銅、硫酸,過濾后濾液回收,氯化亞銅經水洗、醇洗、干燥得CuCl產品,
(1)步驟②中主要反應是氧化銅與硫酸反應生成硫酸銅和水,反應的離子方程式為CuO+2H+═Cu2++H2O,
故答案為:CuO+2H+═Cu2++H2O;
(2)步驟③先加NaCl,氯離子濃度較大,產生的氯化亞銅能溶于氯離子濃度較大的體系,難溶于水,所以加水稀釋就產生大量白色沉淀,
故答案為:CuCl可溶于氯離子濃度較大的體系,難溶于水;
(3)氯化亞銅能溶于氯離子濃度較大的體系,所以酸洗只能用硫酸不能用鹽酸,用乙醇洗滌能快速去除CuCl表面的水分,防止其水解氧化,
故答案為:硫酸;快速去除CuCl表面的水分,防止其水解氧化;
(4)反應①S(s)+O2(g)═SO2(g)△H=-296.8 kJ/mol,②2Cu(s)+O2(g)═2CuO(s)△H=-314.6 kJ/mol,③Cu(s)+S(s)═CuS(s)△H=-53.1 kJ/mol,根據蓋斯定律,將①×2+②-③×2可得CuS與O2反應的熱化學方程式為2CuS(s)+3O2(g)═2CuO(s)+2SO2(g)△H=-802.0 kJ/mol,
故答案為:2CuS(s)+3O2(g)═2CuO(s)+2SO2(g)△H=-802.0 kJ/mol;
(5)根據均攤法,位于60°角頂點的原子屬于該晶胞的為$\frac{1}{12}$,位于120°角頂點的原子屬于該晶胞的為$\frac{1}{6}$,根據CuS晶胞結構圖可知,還有一個硫原子位于晶胞體內,所以晶胞中含有硫原子的數目是為$\frac{1}{12}$×4+$\frac{1}{6}$×4+1=2,
故答案為:2;
(6)根據④~⑦步操作共損失產品3.5%可知,生產100 kg 96.5%的CuCl,則反應③中產生的CuCl的質量為$\frac{100Kg×96.5%}{1-3.5%}$=100 kg,根據反應2CuS+3O2═2CuO+2SO2、2CuO+SO2+2NaCl=2CuCl+Na2SO4,可知每生成1molCuCl,會產生0.5mol二氧化硫需要處理,所以生產100 kg 96.5%的CuCl產品,需要處理的尾氣中含SO2的體積為$\frac{100000}{99}×22.4$×0.5L=11.3m3,
故答案為:11.3.
點評 本題考查學生閱讀獲取信息的能力、常用化學用語、晶胞的分析、化學計算的應用等,側重于學生的分析能力、實驗能力和計算能力的考查,注意把握物質的性質以及反應流程,難度中等,注意(6)中利用兩個方程式進行的計算.


科目:高中化學 來源: 題型:選擇題
| A. | 遇酚酞變紅的溶液中:Na+、Cl-、Ba2+、CH3COO- | |
| B. | 常溫下Kw/c(H+)=1×10-13mol/L的溶液中:SO42-、Fe2+、ClO-、NH4+ | |
| C. | 水電離出的c(H+)=10-10mol/L的溶液中:Na+、K+、Cl-、HCO3- | |
| D. | 0.5mol/LAlCl3溶液中可能大量存在:Ca2+、AlO2-、K+、CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SO2溶于水,其水溶液能導電,說明SO2是電解質 | |
| B. | 向純水中加入鹽酸或金屬鈉都能使水的電離平衡逆向移動,水的離子積不變 | |
| C. | 向氯水中加入NaHCO3 (固體)可使溶液中c(HClO)增大 | |
| D. | 室溫下,將濃度為0.1 mol•L-1 HF溶液加水稀釋,其電離平衡常數和 c(H+)/c(HF)均不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向KCl溶液中滴加幾滴酚酞試液,溶液顏色變紅 | |
| B. | 向KI溶液中通入適量Cl2后,溶液顏色變深 | |
| C. | 溴水與NaCl溶液混合時,會發生置換反應 | |
| D. | NaCl溶液在空氣中會被氧化,故需要密封保存 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 除去氯化鈉溶液中的泥沙--蒸發結晶 | |
| B. | 分離水和乙醇--蒸餾 | |
| C. | 用四氯化碳提取溴水中的溴單質--萃取 | |
| D. | 分離汽油和水--分液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②⑤ | B. | ①②③ | C. | ⑤ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在船舶的外殼裝上銅塊可防止其發生電化學腐蝕 | |
| B. | FeCl3溶液和Fe2(SO4)3溶液加熱蒸干、灼燒都得到Fe2O3 | |
| C. | MnO2、FeCl3和CuSO4都可加快H2O2的分解速率 | |
| D. | 用惰性電極分別電解CuCl2溶液和MgCl2溶液分別得到單質Cu和Mg |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com