
科目:高中化學 來源: 題型:選擇題
| A. | 使用可降解塑料制品 | |
| B. | 工業廢氣排入大氣 | |
| C. | 對化石燃料進行綜合利用 | |
| D. | 盡量采取步行、騎自行車或乘坐公共交通工具等方式出行 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | ① | ② | ③ | 實驗結論 | 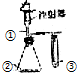 |
| A | 稀鹽酸 | Na2SO4 | 溴水 | SO2具有漂白性 | |
| B | 濃氨水 | CaO | AlCl3溶液 | 白色沉淀生成后又溶解 | |
| C | 雙氧水 | MnO2 | KI溶液 | 氧化性:O2>I2 | |
| D | 稀醋酸 | Na2CO3 | Na2SiO3溶液 | 酸性:醋酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在標準狀況下,2.24 L二氧化硫與氧氣混合氣體中所含氧原子數為0.2 NA | |
| B. | 假設1mol氯化鐵完全轉化為氫氧化鐵膠體,則分散系中膠體微粒數為NA | |
| C. | 60g冰醋酸中,所含陰、陽離子總數為2NA | |
| D. | 標準狀況下,3.36L乙烷中含有的非極性鍵數為1.05NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;粒子E的名稱是水合氫離子;粒子F對應的元素在周期表中的位置是第三周期、ⅢA族.
;粒子E的名稱是水合氫離子;粒子F對應的元素在周期表中的位置是第三周期、ⅢA族.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com