
【題目】有研究人員在體外實驗中發現藥物瑞德西韋對新冠病毒有明顯抑制作用。E是合成瑞德西韋的中間體,其合成路線如下:
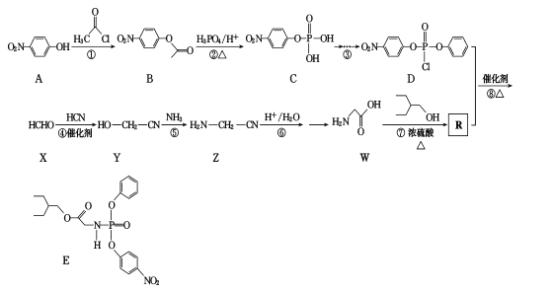
回答下列問題:
(1)W的化學名稱為____;反應①的反應類型為____
(2)A中含氧官能團的名稱為____。
(3)寫出反應⑦的化學方程式_____
(4)滿足下列條件的B的同分異構體有____種(不包括立體異構)。
①苯的二取代物且苯環上含有硝基;②可以發生水解反應。
上述同分異構體中核磁共振氫譜為3:2:2的結構簡式為____________
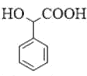
(5)有機物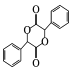 中手性碳(已知與4個不同的原子或原子團相連的碳原子稱為手性碳)有 ___個。結合題給信息和已學知識,設計由苯甲醇為原料制備
中手性碳(已知與4個不同的原子或原子團相連的碳原子稱為手性碳)有 ___個。結合題給信息和已學知識,設計由苯甲醇為原料制備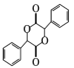 的合成路線_______ (無機試劑任選)。
的合成路線_______ (無機試劑任選)。
【答案】氨基乙酸 取代反應 硝基和羥基 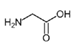 +
+
![]()
 +H2O 8
+H2O 8 ![]() 2
2 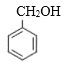
![]()
![]()
![]()
![]()
![]()
【解析】
根據流程圖,A(![]() )和
)和![]() 發生取代反應生成B(
發生取代反應生成B(![]() ),B和磷酸在加熱條件下發生取代生成C,C在一定條件下轉化為
),B和磷酸在加熱條件下發生取代生成C,C在一定條件下轉化為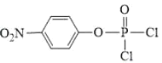 ,
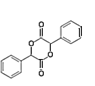
, 中的一個氯原子被取代轉化為D;X與HCN發生加成反應生成Y,Y和氨氣在一定條件下發生取代反應生成Z,Z在酸性條件下水解得到W,D和R在一定條件下反應生成E,根據E和D的結構簡式,可推出R的結構簡式為
中的一個氯原子被取代轉化為D;X與HCN發生加成反應生成Y,Y和氨氣在一定條件下發生取代反應生成Z,Z在酸性條件下水解得到W,D和R在一定條件下反應生成E,根據E和D的結構簡式,可推出R的結構簡式為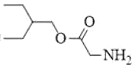 ,由此可知W和
,由此可知W和![]() 在濃硫酸加熱條件下發生酯化反應生成R,據此分析解答。
在濃硫酸加熱條件下發生酯化反應生成R,據此分析解答。
(1)W的結構簡式為![]() ,結構中有羧基和氨基,化學名稱為氨基乙酸;根據分析,反應①為A(
,結構中有羧基和氨基,化學名稱為氨基乙酸;根據分析,反應①為A(![]() )和
)和![]() 發生取代反應生成B(
發生取代反應生成B(![]() ),反應類型為取代反應;
),反應類型為取代反應;
(2)A的結構簡式為![]() ,含氧官能團的名稱為硝基和羥基;
,含氧官能團的名稱為硝基和羥基;
(3)根據分析,反應⑦為W和![]() 在濃硫酸加熱條件下發生酯化反應生成R,R的結構簡式為
在濃硫酸加熱條件下發生酯化反應生成R,R的結構簡式為 ,化學方程式
,化學方程式 +
+
![]()
 +H2O;
+H2O;
(4)B的結構簡式為![]() ,①苯的二取代物且苯環上含有硝基;②可以發生水解反應,說明另一個取代基為酯基,該酯基的結構可為-OOCCH3或-COOCH3或-CH2OOCH,在苯環上與硝基分別有鄰間對三種位置,分別為:
,①苯的二取代物且苯環上含有硝基;②可以發生水解反應,說明另一個取代基為酯基,該酯基的結構可為-OOCCH3或-COOCH3或-CH2OOCH,在苯環上與硝基分別有鄰間對三種位置,分別為: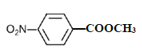 、
、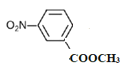 、
、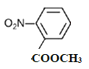 、
、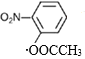 、
、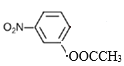 、
、![]() 、
、![]() 、
、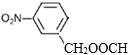 、
、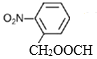 ,除去自身外結構外,共有8種; 上述同分異構體中核磁共振氫譜為3:2:2,說明分子中含有三種不同環境的氫原子且個數比為3:2:2,則符合要求的結構簡式為
,除去自身外結構外,共有8種; 上述同分異構體中核磁共振氫譜為3:2:2,說明分子中含有三種不同環境的氫原子且個數比為3:2:2,則符合要求的結構簡式為![]() ;
;
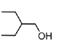
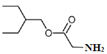
(5)已知與4個不同的原子或原子團相連的碳原子稱為手性碳,有機物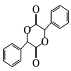 中手性碳的位置為
中手性碳的位置為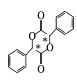 ,有2個;
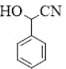
,有2個;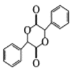 的水解產物為
的水解產物為 ,
, 的結構中的-COOH可由-CN酸性條件下水解得到,而
的結構中的-COOH可由-CN酸性條件下水解得到,而![]() 與HCN發生加成反應可生成
與HCN發生加成反應可生成 ,再結合苯甲醇催化氧化可得到苯甲醛,則合成路線為:
,再結合苯甲醇催化氧化可得到苯甲醛,則合成路線為:
![]()
![]()
![]()

![]()

![]()
 。
。


科目:高中化學 來源: 題型:
【題目】實驗室里從海藻中提取碘的流程如下圖:
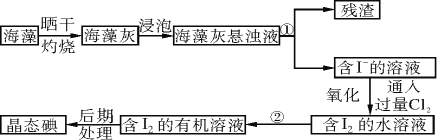
(1)指出制取碘的過程中有關的實驗操作名稱(或儀器):
①操作名稱________________,②儀器________________。
(2)提取碘的過程中,可供選擇的有機溶劑是________(填字母序號)。
a.甲苯、酒精 b.四氯化碳、苯
c.汽油、乙酸 d.汽油、甘油
(3)含碘的有機物溶液中提取碘和回收有機溶劑,還需要經過蒸餾,觀察下列實驗裝置指出其錯誤之處,并指出正確操作。____________________________________。
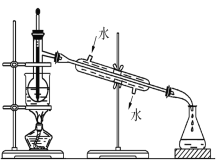
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA表示阿伏加德羅常數的值。下列說法正確的是( )
A.14g聚丙烯中含C-H鍵總數目為2NA
B.常溫下,pH=13的NaOH溶液中含有的OH-數目為0.1NA
C.100mL12mol·L-1濃硝酸與過量Cu反應轉移電子的數目為0.6NA
D.電解精煉銅時,若陽極質量減少64g,則陰極得到電子的數目為2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應N2O4(g) ![]() 2NO2(g) ΔH=+57kJ·mol-1,在溫度為T1、T2時,平衡體系中NO2的體積分數隨壓強變化曲線如圖所示。下列說法不正確的是
2NO2(g) ΔH=+57kJ·mol-1,在溫度為T1、T2時,平衡體系中NO2的體積分數隨壓強變化曲線如圖所示。下列說法不正確的是
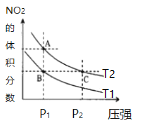
A.A點的反應速率小于C點的反應速率
B.A、C兩點氣體的顏色:A淺,C深
C.由狀態B到狀態A,可以用降溫的方法
D.A、C兩點氣體的平均相對分子質量:A<C
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮及其化合物在生產生活中應用廣泛。回答下列問題:
(1)“中國制造2025”是中國政府實施制造強國戰略第一個十年行動綱領。氮化鉻(CrN)具有極高的硬度和力學強度、優異的抗腐蝕性能和高溫穩定性能,氮化鉻在現代工業中發揮更重要的作用,請寫出Cr3+的外圍電子排布式____;基態鉻、氮原子的核外未成對電子數之比為____。
(2)氮化鉻的晶體結構類型與氯化鈉相同,但氮化鉻熔點(1282℃)比氯化鈉 (801'C)的高,主要原因是________。
(3)過硫酸銨[(NH4)2S2O8],廣泛地用于蓄電池工業、石油開采、淀粉加工、油脂工業、照相工業等,過硫酸銨中N、S、O的第一電離能由大到小的順序為 _______,其中NH4+的空間構型為____________
(4)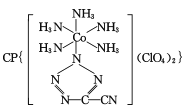 是20世紀80年代美國研制的典型鈍感起爆藥Ⅲ,它是由
是20世紀80年代美國研制的典型鈍感起爆藥Ⅲ,它是由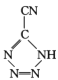 和[Co(NH3)5H2O](ClO4)3反應合成的,
和[Co(NH3)5H2O](ClO4)3反應合成的,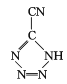 中孤電子對與π鍵比值為 _______, CP的中心Co3+的配位數為 ______ 。
中孤電子對與π鍵比值為 _______, CP的中心Co3+的配位數為 ______ 。
(5)鐵氮化合物是磁性材料研究中的熱點課題之一,因其具有高飽和磁化強度、低矯頑力,有望獲得較高的微波磁導率,具有極大的市場潛力,其四子格結構如圖所示,已知晶體密度為ρgcm-3,阿伏加德羅常數為NA。
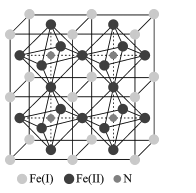
①寫出氮化鐵中鐵的堆積方式為____。
②該化合物的化學式為 ___。
③計算出 Fe(II)圍成的八面體的體積為____cm3。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某科研人員以廢鎳催化劑(主要成分為NiO,另含Fe2O3、CaO、CuO、BaO)為原料回收鎳,工藝流程如下:

已知:常溫下,有關氫氧化物開始沉淀和沉淀完全的pH如表:

回答下列問題:
(1)浸出渣主要成分為_________(填化學式)。
(2)“除銅”時,Fe3+與H2S反應的離子方程式為__________________。
(3)“氧化”的目的是將溶液中Fe2+氧化為Fe3+,溫度需控制在40~50℃之間,該步驟溫度不能太高的原因是_______________________。
(4)“調pH”時,pH的控制范圍為_________。
(5)在堿性條件下,電解產生2NiOOH·H2O的原理分兩步,其中第一步是Cl-在陽極被氧化為ClO-,則該電極反應式為_______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列中心原子的雜化軌道類型和分子幾何構型不正確的是
A. CCl4中C原子sp3雜化,為正四面體形
B. H2S分子中,S為sp2雜化,為直線形
C. CS2中C原子sp雜化,為直線形
D. BF3中B原子sp2雜化,為平面三角形
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,將一元酸HA的溶液和KOH溶液等體積混合(忽略體積變化),實驗數據如下表:
實驗編號 | 起始濃度/(mol·L-1) | 反應后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判斷不正確的是
A.實驗①反應后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.實驗①反應后的溶液中:c(OH-)=c(K+)-c(A-)=![]() mol/L
mol/L
C.實驗②反應后的溶液中:c(A-)+c(HA)>0.1mol·L-1
D.實驗②反應后的溶液中:c(K+)=c(A-)>c(OH-) =c(H+)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com