
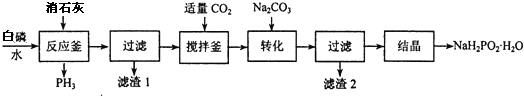
分析 白磷消石灰在反應釜中生成PH3和次磷酸二氫鈣,過濾得到濾液通入適量二氧化碳除去過量的氫氧化鈣,加入碳酸鈉轉化為次磷酸鈉,結晶得到次磷酸鈉晶體,
(1)根據化學平衡常數表達式完成;磷化氫是一種易燃在常溫下催化氧化為磷酸的反應方程式;
(2)反應釜中另一種生成物為次磷酸二氫鈣,過濾所得濾液呈堿性,通入二氧化碳中和過量的堿;加入碳酸鈉,生成了碳酸鈣沉淀,過濾后濾渣2碳酸鈣;
(3)堿性條件下,次磷酸根離子被氧化為HPO32-的反應方程式.
解答 解:(1)4PH3(g)?P4(g)+6H2(g)反應的平衡常數表達式為:$\frac{{c}^{6}({H}_{2})c({P}_{4})}{{c}^{4}(P{H}_{3})}$;磷化氫是一種易燃、有毒的氣體,可以在常溫下催化氧化為磷酸,反應的化學方程式為:PH3+2O2$\frac{\underline{\;催化劑\;}}{\;}$H3PO4,
故答案為:$\frac{{c}^{6}({H}_{2})c({P}_{4})}{{c}^{4}(P{H}_{3})}$; PH3+2O2$\frac{\underline{\;催化劑\;}}{\;}$H3PO4;
(2)反應釜中另一種生成物為次磷酸二氫鈣,白磷和氫氧化鈣在水溶液中反應生成次磷酸二氫鈣和PH3,反應的化學方程式為:2P4+3Ca(OH)2+6H2O=3Ca(H2PO2)2+2PH3↑,由于過濾后所得濾液呈堿性,通入二氧化碳用于中和過量的堿,上一步加入碳酸鈉,生成了碳酸鈣沉淀,過濾后濾渣2碳酸鈣,
故答案為:2P4+3Ca(OH)2+6H2O=3Ca(H2PO2)2+2PH3↑;中和過量堿(或調節溶液pH或除去部分Ca2+離子);CaCO3;
(3)在堿性條件下,次磷酸根離子被氧化為HPO32-,反應的離子方程式為:Cu2++H2PO2-+3OH-═Cu+HPO32-+2H2O,
故答案為:Cu2++H2PO2-+3OH-═Cu+HPO32-+2H2O.
點評 本題考查了以黃磷(P4)為原料制備次磷酸鈉晶體的工藝流程,關鍵在于對工藝流程的理解,和知識的遷移運用,本題難度中等.


 開心蛙狀元作業系列答案
開心蛙狀元作業系列答案 課時掌控隨堂練習系列答案
課時掌控隨堂練習系列答案 一課一練一本通系列答案
一課一練一本通系列答案 浙江之星學業水平測試系列答案
浙江之星學業水平測試系列答案科目:高中化學 來源: 題型:選擇題
| A. | 1:1 | B. | 2:5 | C. | 3:2 | D. | 3:5 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
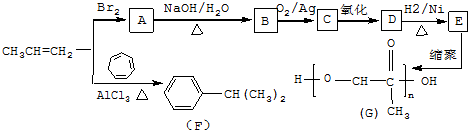
 ,C發生銀鏡反應的化學方程式
,C發生銀鏡反應的化學方程式 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
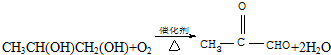
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ?+3nO2$\stackrel{點燃}{→}$2nCO2+2nH2O.
?+3nO2$\stackrel{點燃}{→}$2nCO2+2nH2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③⑤ | B. | ②④⑥ | C. | ⑤⑦ | D. | ⑥⑦ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鍍銅鐵制品鍍層受損后,鐵制品比受損前更容易生銹 | |
| B. | CaCO3(s)═CaO(s)+CO2(g)室溫下不能自發進行,說明該反應的△H<0 | |
| C. | N2(g)+3H2(g)═2NH3(g)△H<0,升高溫度,反應速率v(H2 )和H2的平衡轉化率均增大 | |
| D. | 水的離子積常數Kw隨著溫度的升高而增大,說明水的電離是放熱反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 煤的干餾和石油的分餾都屬化學變化 | |
| B. | 硫酸鋇在醫學上用作鋇餐,鋇離子對人體無害 | |
| C. | 碳-14可用作文物年代的鑒定,碳-14與碳-12互為同素異形體 | |
| D. | 葡萄糖注射液不能產生丁達爾效應現象,不屬于膠體 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com