
 實驗室中有一未知濃度的稀鹽酸,某學生為測定鹽酸的濃度在實驗室中進行如下實驗:請完成下列填空:
實驗室中有一未知濃度的稀鹽酸,某學生為測定鹽酸的濃度在實驗室中進行如下實驗:請完成下列填空:| 實驗編號 | NaOH溶液的濃度 (mol/L) | 滴定完成時,NaOH溶液滴入的體積(mL) | 待測鹽酸溶液的體積 (mL) |
| 1 | 0.10 | 22.50 | 20.00 |
| 2 | 0.10 | 18.56 | 20.00 |
| 3 | 0.10 | 18.54 | 20.00 |
分析 ①根據滴定管的結構和精確度以及測量的原理;如溶液顏色變化且半分鐘內不變色,可說明達到滴定終點;
②先判斷數據的合理性,求出標準NaOH溶液體積,然后依據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$求出即可;
③氫氧化鈉為堿性物質,應選擇堿式滴定管乙;
④依據(2)中公式,分析不當操作對V(標準)的影響,不當操作導致消耗標準液偏多的,結果偏大,否則偏小,以此判斷濃度的誤差.
解答 解:①滴定管小數在上,大數在下,精確度為0.01mL,所以第一次實驗滴定完用去NaOH溶液的體積22.50mL;滴定時,當溶液顏色變化且半分鐘內不變色,可說明達到滴定終點,即酚酞在酸中為無色,在堿性溶液中顯淺紅色;
故答案為:22.50mL;當滴入最后一滴氫氧化鈉溶液時,溶液由無色恰好變成淺紅色,且半分鐘內不褪色;
②舍去誤差較大的數,得出V(標準)=$\frac{18.56+18.54}{2}$=18.55mL,c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$=0.093mol/L;
故答案為:0.093mol/L;
③氫氧化鈉為堿性物質,應選擇堿式滴定管乙;
故答案為:乙;
④A、滴定終點讀數時俯視讀數,造成標準液偏小,根據c(待測)公式分析,結果偏小,故不選;
B、酸式滴定管使用前,水洗后未用待測鹽酸溶液潤洗,導致消耗的標準液體積偏小,結果偏小,故不選;
C、錐形瓶水洗后未干燥,對消耗標準液的體積無影響,結果準確,故不選;
D、稱量前NaOH固體中混有Na2CO3固體,等質量的碳酸鈉和氫氧化鈉,碳酸鈉消耗的鹽酸偏低,在滴定時消耗的標準液體積偏大,導致消耗的標準液偏多,結果偏大,故選;
E、配制好的NaOH標準溶液保存不當,部分與空氣中的CO2反應生成了Na2CO3,等物質的量的碳酸鈉與氫氧化鈉消耗的氯化氫相等,滴定時消耗的標準液體積不變,測定結果不變,故不選;
F、堿式滴定管尖嘴部分有氣泡,滴定后消失,導致消耗的標準液體積讀數偏大,故選;
故選:D、F.
點評 本題考查了酸堿中和滴定實驗及誤差分析,掌握中和滴定的操作方法及完成分析的方法是解題關鍵,注意依據公式c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$進行誤差分析,題目難度中等.


科目:高中化學 來源: 題型:解答題
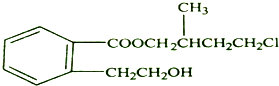
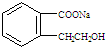 .
.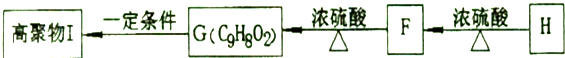
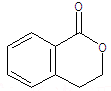 .②由F生成的G化學方程式
.②由F生成的G化學方程式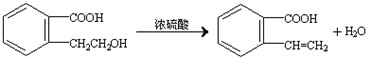 .
.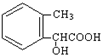 .
.查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | FeCl3溶液與Cu粉反應:Cu+2Fe3+═Cu2++2Fe2+ | |
| B. | 鈉與水反應:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 氯氣與水反應:Cl2+H2O?2H++Cl-+ClO- | |
| D. | 氯化鋁溶液與過量氨水反應:3NH3•H2O+Al3+=Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氣體的體積和體系的壓強 | B. | 溶液顏色的深淺 | ||
| C. | 固體物質的體積 | D. | H+濃度的變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 密度/g•cm-3 | 沸點/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水 |
| 對硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液態烴 |
| 鄰硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液態烴 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某研究性學習小組設計了一組實驗,驗證元素周期律.
某研究性學習小組設計了一組實驗,驗證元素周期律.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
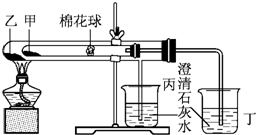 下列是某興趣小組根據課本實驗設計的一個能說明碳酸鈉與碳酸氫鈉熱穩定性的套管實驗.請觀察下圖的實驗裝置,分析實驗原理,回答下列問題:
下列是某興趣小組根據課本實驗設計的一個能說明碳酸鈉與碳酸氫鈉熱穩定性的套管實驗.請觀察下圖的實驗裝置,分析實驗原理,回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
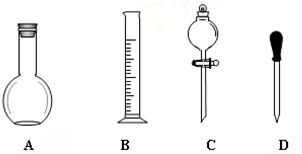 實驗室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根據這兩種溶液的配制情況回答下列問題.
實驗室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根據這兩種溶液的配制情況回答下列問題.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com