

 ;該元素還可與元素①形成10電子的氣體分子Y,將過量的Y氣體通入盛有含⑩元素的硫酸鹽溶液中,反應過程中的實驗現象為:先產生藍色沉淀,后沉消失,變成深藍色的溶液;反應過程中的離子方程式為Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
;該元素還可與元素①形成10電子的氣體分子Y,將過量的Y氣體通入盛有含⑩元素的硫酸鹽溶液中,反應過程中的實驗現象為:先產生藍色沉淀,后沉消失,變成深藍色的溶液;反應過程中的離子方程式為Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH- 分析 根據元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分別是H、C、O、Mg、Al、S、Cl、Ca、Ni、Cu元素,
(1)利用均攤法確定其化學式;
(2)②為C元素,碳元素一種氫化物是的產量作為衡量石油化工發展水平的標志,該氫化物為C2H4,C元素電負性不大,分子中不存在氫鍵,為對稱結構,屬于非極性分子,分子中含有1個C=C雙鍵、4個C-H鍵,單鍵為σ鍵,雙鍵中1個σ鍵、1個π鍵,根據雜化軌道數目確定雜化方式;
(3)某元素的價電子排布式為nsnnpn+1,s能級上最多排列2個電子,所以n=2,則該元素的價電子排布式為:2s22p3,為N元素,該元素與元素①形成的18電子的X分子是N2H4,該元素還可與元素①形成10電子的氣體分子Y,Y是NH3,過量的氨氣和硫酸銅溶液中,氨氣先和水反應生成一水合氨,硫酸銅和一水合氨反應生成氫氧化銅藍色沉淀,氫氧化銅和一水合氨反應生成銅氨絡合物;
(4)同一周期元素中,元素的電負性隨著原子序數的增大而增大,同一主族中,元素的電負性隨著原子序數的增大而減小;
(5)根據ρ=$\frac{m}{V}$計算密度.
解答 解:根據元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分別是H、C、O、Mg、Al、S、Cl、Ca、Ni、Cu元素,
(1)由元素指周期表中的位置可知,②為C元素、④為Mg元素、⑨為Ni元素,根據晶胞結構可知,晶胞中C原子數目為1,Mg原子數目為8×$\frac{1}{8}$=1,Ni原子數目為6×$\frac{1}{2}$=3,該物質化學式為:MgNi3C,
故答案為:MgNi3C;
(2)②為C元素,碳元素一種氫化物是的產量作為衡量石油化工發展水平的標志,該氫化物為C2H4,
A.C元素電負性不大,所以乙烯分子中不存在氫鍵,故A錯誤
B.碳氫原子之間存在極性鍵,且乙烯為對稱結構,屬于非極性分子,故B正確;
C.分子中含有1個C=C雙鍵、4個C-H鍵,單鍵為σ鍵,雙鍵中1個σ鍵、1個π鍵,含有5個σ鍵和1個π鍵,故C錯誤;
D.C原子呈1個C=C雙鍵、2個C-H鍵,雜化軌道數為3,原子采用sp2雜化,故D正確;
故選:BD;
(3)某元素的價電子排布式為nsnnpn+1,s能級上最多排列2個電子,所以n=2,則該元素的價電子排布式為:2s22p3,為N元素,該元素與元素①形成的18電子的X分子是N2H4,其結構式為: ;
;
該元素還可與元素①形成10電子的氣體分子Y,Y是NH3,過量的氨氣和硫酸銅溶液中,氨氣先和水反應生成一水合氨,硫酸銅和一水合氨反應生成氫氧化銅藍色沉淀,氫氧化銅和一水合氨反應生成銅氨絡合物,離子反應方程式為:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,
故答案為: ;先產生藍色沉淀,后沉消失,變成深藍色的溶液;Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
;先產生藍色沉淀,后沉消失,變成深藍色的溶液;Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
(4)同一周期元素中,元素的電負性隨著原子序數的增大而增大,同一主族中,元素的電負性隨著原子序數的增大而減小,所以這幾種元素電負性大小順序是Ca<Al<S<Cl<O,
故答案為:Ca<Al<S<Cl<O;
(5)⑩元素單質晶體是面心立方體,該晶胞中銅原子個數=8×$\frac{1}{8}$$+6×\frac{1}{2}$=4,銅原子半徑為d cm,晶胞的棱長=$\sqrt{\frac{({4d)}^{2}}{2}}$cm=2$\sqrt{2}$dcm,則其體積=(2$\sqrt{2}$dcm)3,ρ=$\frac{m}{V}$=$\frac{4a}{(2\sqrt{2}d)^{3}}$g•cm-3=$\frac{\sqrt{2}a}{8p9vv5xb5^{3}}$g•cm-3,
故答案為:$\frac{\sqrt{2}a}{8p9vv5xb5^{3}}$.
點評 本題考查了物質結構和性質,涉及化學式的確定、晶胞的計算、電負性大小的比較等知識點,同時考查學生空間想象能力,根據元素周期律來分析解答,難點是密度的計算,要結合密度公式來解答,難度較大.


科目:高中化學 來源: 題型:選擇題

| A. | 向a試管中先加入濃硫酸,然后邊搖動試管邊慢慢加入乙醇,再加入冰醋酸 | |
| B. | 試管b中導氣管下端管口不能侵入液面的目的是防止實驗過程中產生倒吸現象 | |
| C. | 實驗時加熱試管a需小心均勻加熱的原因是避免液體劇烈沸騰,減少乙醇,乙酸的揮發,防止溫度過高時發生炭化 | |
| D. | 試管b中飽和Na2CO3溶液的作用是吸收隨乙酸乙酯蒸出的少量乙酸和乙酯 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;該化合物的晶體類型離子晶體
;該化合物的晶體類型離子晶體查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 元素編號 | 元素性質或原子結構 |
| X | 最外層電子數是次外層電子數的2倍 |
| Y | 常溫下單質為雙原子分子,其氫化物水溶液呈堿性 |
| Z | 最外層電子數比次外層電子數少5個電子 |
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 熱激活電池可用作火箭、導彈的工作電源.一種熱激活電池的基本結構如圖所示,其中作為電解質的無水LiCl-KCl混合物受熱熔融后,電池即可瞬間輸出電能.該電池總反應為:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有關說法正確的是( )
熱激活電池可用作火箭、導彈的工作電源.一種熱激活電池的基本結構如圖所示,其中作為電解質的無水LiCl-KCl混合物受熱熔融后,電池即可瞬間輸出電能.該電池總反應為:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有關說法正確的是( )| A. | 正極反應式:Ca+2Cl--2e-═CaCl2 | |
| B. | 放電過程中,Li+向負極移動 | |
| C. | 每轉移0.1 mol電子,理論上生成20.7 g Pb | |
| D. | 常溫時,在正負極間接上電流表或檢流計,指針不偏轉 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
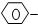 、-COOH 4種基團兩兩組合而成的有機物中,能跟NaOH溶液發生化學反應的有( )
、-COOH 4種基團兩兩組合而成的有機物中,能跟NaOH溶液發生化學反應的有( )| A. | 3種 | B. | 4種 | C. | 5種 | D. | 6種 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com