
【題目】X是第四周期元素,最外層只有1個電子,次外層的所有原子軌道均充滿電子。元素Y的負一價離子的最外層電子數與次外層的相同。回答下列問題:
(1)單質X的晶體類型為___________,其中X原子的配位數為___________。
(2)元素Y基態原子的核外電子排布式為_____________,同周期元素中,第一電離能最大的是___________(寫元素符號)。
(3)X與Y形成的一種化合物的立方晶胞如圖所示。
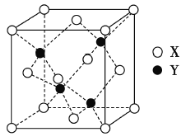
①該化合物的化學式為____________________,已知晶胞參數a=0.542nm,此晶體的密度為____________ g·cm-3。(寫出計算式,不要求計算結果。阿伏加德羅常數為NA)
②該化合物難溶于水但易溶于氨水,其原因是________。
【答案】金屬晶體 12 1s22s22p63s23p5 Ar CuCl ![]() Cu2+可與氨形成易溶于水的配位化合物(或配離子)
Cu2+可與氨形成易溶于水的配位化合物(或配離子)
【解析】
X是第四周期元素,最外層只有1個電子,次外層的所有原子軌道均充滿電子,原子核外電子數=2+8+18+1=29,則X為Cu;元素Y的負一價離子的最外層電子數與次外層的相同,原子只能有3個電子層,最外層電子數為7,則Y為Cl元素。
(1)銅是金屬,屬于金屬晶體,晶體中金屬陽離子與電子之間通過金屬鍵結合在一起;銅晶體中原子為面心立方最密堆積;
(2)Y是Cl元素,Cl是17號元素,結合能量最低原理書寫原子核外電子排布式;同一周期元素中稀有氣體的第一電離能最大;
(3)①均攤法計算晶胞中Cu、Cl原子數目,確定化學式,計算晶胞中原子總質量,晶體密度![]() 計算;②根據物質容易形成配位化合物分析。
計算;②根據物質容易形成配位化合物分析。
根據上述推斷可知X是Cu元素,Y是Cl元素。
(1)銅屬于金屬,金屬陽離子與電子之間通過金屬鍵結合在一起,晶體類型為金屬晶體,銅晶體是面心立方最密堆積,銅原子的配位數是12;
(2)Cl元素是17號元素,根據構造原理可知基態Cl原子核外電子排布式為1s22s22p63s23p5,Cl位于第三周期,同一周期的元素的第一電離能隨原子序數的增大而增大,所以稀有氣體原子為穩定結構,其同周期元素中第一電離能最大的是Ar;
(3)①晶胞中含有銅原子個數為:8×![]() +6×
+6×![]() =4,Cl原子個數為4,Cu、Cl原子數目之比為1:1,則化學式為:CuCl,晶胞質量m(晶胞)=4×
=4,Cl原子個數為4,Cu、Cl原子數目之比為1:1,則化學式為:CuCl,晶胞質量m(晶胞)=4×![]() g,則晶體的密度ρ=
g,則晶體的密度ρ=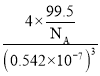 g/cm3=
g/cm3=![]() g/cm3;②Cu2+容易與氨水中的NH3形成絡離子,因此容易溶解在氨水中。
g/cm3;②Cu2+容易與氨水中的NH3形成絡離子,因此容易溶解在氨水中。


科目:高中化學 來源: 題型:
【題目】胡妥油(D)是香料的原料,它可由 A 合成得到: 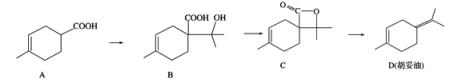
下列說法正確的是( )
A.有機物 B 的分子式為 C11H19O3
B.1mol B 與足量的 Na 反應可產生 11.2LH 2 (已換算成標準狀況)
C.有機物 C 的所有同分異構體中可能有芳香族化合物存在
D.一定條件下,A分別可以發生加成、取代、氧化等反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某實驗小組設計如下實驗裝置(圖中夾持裝置省略)測定制備的CaCO3粉末的純度(樣品中雜質不與酸反應,反應前裝置中的CO2已全部排出)。下列說法錯誤的是( )
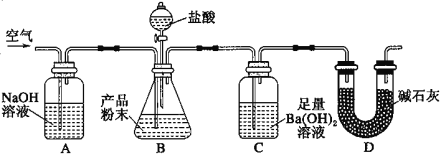
A.緩緩通入空氣的作用是將反應結束后裝置中殘留的CO2全部鼓入到C裝置中被吸收
B.A裝置和D裝置都是為了防止空氣中的CO2氣體進入C 裝置而產生誤差
C.若CaCO3樣品的質量為x,從C 中取出的沉淀洗凈干燥后的質量為y,則CaCO3的純度為![]()
D.為了防止B 中鹽酸揮發產生干擾,必須在B、C裝置中間加一個裝有飽和碳酸氫鈉溶液的洗氣瓶
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關硫元素及其化合物的說法正確的是
A.硫黃礦制備硫酸經歷兩步:S![]() SO3
SO3![]() H2SO4
H2SO4
B.酸雨與土壤中的金屬氧化物反應后,硫元素以單質的形式進入土壤中
C.在燃煤中加入石灰石可減少SO2排放,發生的反應為2CaCO3+2SO2+O2![]() 2CO2+2CaSO4
2CO2+2CaSO4
D.向溶液中加入BaCl2溶液后滴加硝酸,若產生不溶于硝酸的白色沉淀,則溶液必含SO42-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】—定條件下,向密閉容器中充入一定量的氣體X,發生反應3X(g)![]() Y(g)+xZ(g),一段時間后反應達到平衡。12min時,將容器體積壓縮至原來的一半,一段時間后反應再次達到平衡。反應中各時刻X物質的濃度如下表所示。下列說法中不正確的是( )
Y(g)+xZ(g),一段時間后反應達到平衡。12min時,將容器體積壓縮至原來的一半,一段時間后反應再次達到平衡。反應中各時刻X物質的濃度如下表所示。下列說法中不正確的是( )
反應時間(min) | 0 | 5 | 12 | 17 | 20 |
X的濃度(mol·L-1) | 1.0 | 0.4 | 0.4 | 0.7 | 0.7 |
A.x=1
B.5min時該反應處于化學平衡狀態
C.從反應開始到18min時,X的轉化率為30%
D.05min內,該反應的平均速率為v(X)=0.12mol·L-1·min-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)如圖為測定中和熱的實驗裝置圖。請回答下列問題:
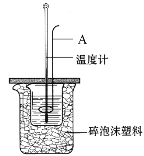
①儀器A的名稱為___;
②如果用0.50mol·L-1的鹽酸和氫氧化鈉固體進行實驗,則實驗中所測出的“中和熱”的數值將___(填“偏大”、“偏小”或“不變”)
(2)近期發現,H2S是繼NO、CO之后的第三個生命體系氣體信號分子,它具有參與調節神經信號傳遞、舒張血管減輕高血壓的功能。如圖是通過熱化學循環在較低溫度下由水或硫化氫分解制備氫氣的反應系統原理。

①根據如圖,請寫出系統(II)中制氫的熱化學方程式___;
②系統(I)和系統(II)相比,制得等量H2所需能量較少的是__(填“I”或“II”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有一瓶澄清的溶液,只可能含有 NH4+、Na+、Mg2+、Ba2+、Fe3+、Clˉ、Brˉ、Iˉ、CO32ˉ、SO42—中的幾種,且濃度均為 0.1mol L—1。進行以下實驗:
①取少量溶液,滴加鹽酸至溶液呈酸性,無明顯現象。
②取少量溶液,滴加少許新制氯水,再加淀粉溶液,溶液變藍
③取少量溶液,向其中逐滴加入 NaOH 溶液至堿性,過程中均無沉淀產生。將此溶液分為兩等份,第一份加熱,有氣體放出;第二份溶液中加入Na2CO3 溶液,有白色沉淀生成。下列結論不正確的是
A.肯定含有的陽離子是 NH4+、Ba2+
B.肯定含有的陰離子是Iˉ、Clˉ、Brˉ
C.肯定不含有的離子是 Fe3+、CO32ˉ、SO42ˉ
D.不能確定是否含有的離子是 Na+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)①CH3COONa溶液呈堿性,原因是____________________(用化學用語表達)。
②在CH3COONa溶液中,各個離子濃度大小關系為_________________________
③寫出碳酸鈉溶液中電荷守恒關系式_________________________________________
(2)已知:C(s)+H2O(g)![]() CO(g)+H2(g) △H=+131.3kJ/mol。
CO(g)+H2(g) △H=+131.3kJ/mol。
①該反應是________(填“吸熱”或“放熱”)反應。
②它若反應消耗24gC(s),則反應吸收的熱量為___________。
(3)在一定溫度下,將CO(g)和H2O(g)各0.16mol通入容積為2.0L的恒容密閉容器中,發生反應CO(g)+H2O(g)![]() CO2(g)+H2(g),得到下表中數據:
CO2(g)+H2(g),得到下表中數據:
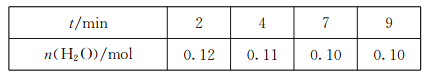
①2min內,v(CO)=________。
②該溫度下,此反應的平衡常數的值是________。
③其他條件不變,再充入0.1molCO和0.molH2O(g),達到平衡時CO的體積分數_____(填“增大”“減小”或“不變”)。
(4)下圖為直流電源電解CuSO4溶液的裝置,C1和C2都為石墨電極。請回答下列問題:
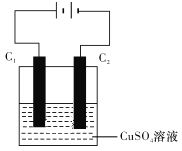
①C1作______(填“陽極”或“陰極”)。
②C2電極的電極反應式為___________。
③惰性電極電解CuSO4溶液的化學方程式是_________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列框圖涉及的物質所含元素中,除一種元素外,其余均為1~18號元素。

已知:A、F為無色氣體單質,B為具有刺激性氣味的氣體,化學家哈伯因合成B獲得1918年的諾貝爾化學獎。C為黑色氧化物,E為紫紅色金屬單質,I為藍色沉淀(部分反應的產物未列出)。請回答下列問題:
(1)常溫下鋁遇到G的濃溶液后表面形成一層致密的保護膜,該現象稱為___________。
(2)E與G的稀溶液反應的離子方程式為_________。
(3)在25 ℃和101 kPa的條件下,將VL的B氣體溶于100 mL水中,得到密度為ρg·mL-1的溶液M,則M溶液的物質的量濃度為________ mol·L-1。(已知25 ℃、101 kPa條件下氣體摩爾體積為24.5 L·mol-1,不必化簡)
(4)分別蘸取B的濃溶液和G的濃溶液的玻璃棒,接近后的現象是_________。
(5)B和C反應的化學方程式為__________。
(6)J、K是同種金屬的不同氯化物,K為白色沉淀。寫出SO2還原J生成K的離子方程式:______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com