

分析 鉻鐵礦加入純堿,通入空氣煅燒,經浸取后得到Na2CrO4、Na2CO3,加入適量硫酸,得到混合溶液乙含有Na2Cr2O7和Na2SO4,然后結晶可得到Na2Cr2O7晶體,
(1)根據正負總化合價之和相等進行分析;
(2)類比Na2SiO3可寫成Na2O•SiO2完成Fe(CrO2)2的氧化物的形式;
(3)根據影響化學反應速率的因素分析;
(4)①固體圖示及題中信息可知,少量不能除盡Na2CO3等雜質,過量會生成Na2Cr3O10等副產物;
②發生了反應2CrO42-+2H+=Cr2O72-+H2O,生成了Na2Cr2O7和Na2SO4;
(5)a連接電源負極,所以a為陰極;b連接電源正極,所以b為電解槽的陽極;陽極發生氧化反應,陰極發生還原反應.
解答 解:(1)Fe(CrO2)2中,氧元素的化合價是-2價,總的負價是-8價,鉻元素的化合價是+3價,2個鉻原子化合價是+6價,所以鐵元素化合價是+2價,
故答案為:+2;
(2)Fe(CrO2)2 中鐵元素化合價是+2價,氧化物為FeO,鉻元素化合價+3價,氧化物為Cr2O3,所以Fe(CrO2)2寫成氧化物形式為FeO•Cr2O3,
故答案為:FeO•Cr2O3 ;
(3)增大反應物接觸面積可以加快反應速率,升高溫度可以大大加快反應速率,
故答案為:粉碎礦石、升高溫度;
(4)①由于少量難以除盡碳酸鈉,過量會發生反應3CrO42-+4H+=Cr3O102-+2H2O,生成了Na2Cr3O10等副產物,所以必須加入適量硫酸,
故答案為:少量不能除盡Na2CO3等雜質,過量會生成Na2Cr3O10等副產物;
②由于發生了反應2CrO42-+2H+=Cr2O72-+H2O,生成了Na2Cr2O7和Na2SO4,所以乙中溶質的化學式Na2Cr2O7和Na2SO4,
故答案為:Na2Cr2O7和Na2SO4;
(5)根據電解槽圖示可知,a為陰極,溶液顯示酸性,溶液中氫離子得到電子,發生還原反應,電極反應為:2H++2e-=H2↑,
b為陽極,鐵失去電子生成亞鐵離子,亞鐵離子被Cr2O72-氧化成鐵離子,反應的方程式為:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,
故答案為:2H++2e-=H2↑;Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O.
點評 本題考查了重鉻酸鈉的制取原理及除雜方法,為高頻考點,側重于學生的分析能力、實驗能力和計算能力的考查,注意合理分析題中信息,難度中等.


 階梯計算系列答案
階梯計算系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 56gFe與足量的鹽酸反應,轉移的電子數為2NA | |
| B. | 標準狀況下,22.4L的水中含有的原子數為3NA | |
| C. | 物質的量濃度為2mol/L的BaCl2溶液中,含有Cl-個數為4NA | |
| D. | 22.4 L CO和CO2的混合氣體中所含的碳原子數一定是NA |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 用丁達爾效應鑒別Fe(OH)3膠體和FeCl3溶液 | |
| B. | 將氧氣和氫氣的混合氣體通過灼熱的氧化銅,以除去其中的氫氣 | |
| C. | 用溶解、過濾的方法分離K2MnO4和MnO2固體的混合物 | |
| D. | 用分液的方法分離煤油和汽油 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
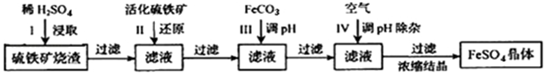
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
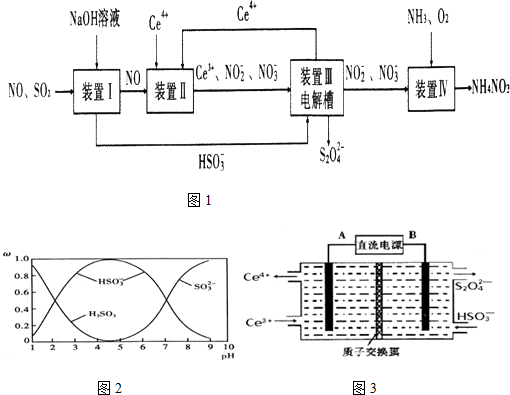
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  由如圖知,石墨轉變為金剛石是放熱反應 | |
| B. |  由如圖知,S(g)+O2(g)═SO2(g)△H1,S(s)+O2(g)═SO2(g)△H2則△H1<△H2 | |
| C. |  由如圖知,白磷比紅磷穩定 | |
| D. |  如由圖知,CO(g)+H2O(g)═CO2(g)+H2(g)△H>0 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
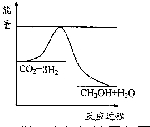 以煤為原料,經過化學加工使煤轉化為氣體、液體、固體燃料以及各種化工產品的工業叫煤化工.
以煤為原料,經過化學加工使煤轉化為氣體、液體、固體燃料以及各種化工產品的工業叫煤化工.| 起始 濃度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com