
 請完成并配平上列的離子方程式.
請完成并配平上列的離子方程式.分析 (1)由信息①可知H3PO2為一元弱酸,則NaH2PO2為正鹽,由信息②可知H3PO2的酸性比醋酸強;
(2)根據氧化還原反應中化合價變化及質量守恒定律判斷反應物和生成物,并配平反應方程式、判斷還原產物;
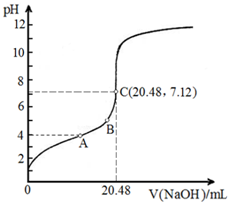
(3)離方程式為:H3PO2?H++H2PO2-,A點時pH=4,則c(H+)=10-4mol/L,結合電離常數計算;
B點所示溶液呈酸性,則c(H+)>c(OH-),由溶液的電中性可知c(H2PO2-)>c(Na;
C點所示溶液中存在:c(H2PO2-)+c(H3PO2)=c(Na+),說明n(H3PO2)=n(NaOH),二者恰好完全反應,以此計算該題.
解答 解:(1)A.次磷酸為弱酸,則電離方程式為:H3PO2?H++H2PO2-,故A正確;
B.NaH2PO2屬于正鹽,故B錯誤;
C.次磷酸為弱酸,則濃度均為0.1mol•L-1的次磷酸(H3PO2)與鹽酸相比前者導電能力弱,故C錯誤;
D.由信息②可知H3PO2的酸性比醋酸強,則0.1mol•L-1NaH2PO2溶液的pH比0.1mol•L-1CH3COONa溶液的pH小,故D正確.
故答案為:AD;
(2)由氧化還原反應中化合價升降相等進行配平:鎳元素的化合價降低了2價,磷元素的化合價升高的2價,根據原子守恒結合電荷守恒可得配平的方程式為:H2O+Ni2++H2PO2-═Ni+H2PO3-+2H+,
故答案為:1;1;1H2O;1;1;2H+;
(3)電離方程式為:H3PO2?H++H2PO2-,A點時pH=4,則c(H+)=10-4mol/L,則$\frac{c({H}_{2}P{{O}_{2}}^{-})}{c({H}_{3}P{O}_{2})}$×(H+)=5.9×10-2,則$\frac{c({H}_{2}P{{O}_{2}}^{-})}{c({H}_{3}P{O}_{2})}$=590,
B點所示溶液呈酸性,則c(H+)>c(OH-),由溶液的電中性可知c(H2PO2-)>c(Na+),則所有離子濃度的大小關系是c(H2PO2-)>c(Na+)>c(H+)>c(OH-),
C點所示溶液中存在:c(H2PO2-)+c(H3PO2)=c(Na+),說明n(H3PO2)=n(NaOH),二者恰好完全反應,此時NaOH的物質的量為0.1000mol•L-1×0.02048L,
則H3PO2的物質的量濃度為$\frac{0.1000mol×0.02048L}{0.02L}$=0.1024 mol/L.
故答案為:590;c(H2PO2-)>c(Na+)>c(H+)>c(OH-);0.1024 mol/L.
點評 本題考查了弱電解質的電離,根據弱電解質的電離平衡特點、酸堿混合溶液酸堿性等知識點來分析解答,靈活運用微粒間關系找出這幾個常數之間的關系式是解本題關鍵,側重考查學生分析計算能力,題目難度中等.


科目:高中化學 來源: 題型:填空題
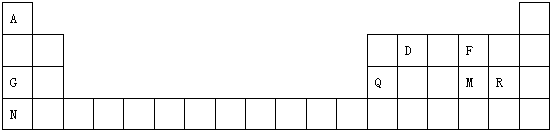
 原子序數依次增大的A、B、C、D、E、F六種元素.其中A的基態原子有3個不同能級,各能級中的電子數相等;C的基態原子2p能級上的未成對電子數與A原子的相同;D為它所在周期中原子半徑最大的主族元素;E,F和C位于同一主族,F處于第一個長周期.
原子序數依次增大的A、B、C、D、E、F六種元素.其中A的基態原子有3個不同能級,各能級中的電子數相等;C的基態原子2p能級上的未成對電子數與A原子的相同;D為它所在周期中原子半徑最大的主族元素;E,F和C位于同一主族,F處于第一個長周期.查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
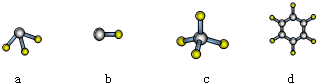
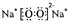 ,該物質含有的化學鍵的類型是離子鍵、非極性共價鍵 .
,該物質含有的化學鍵的類型是離子鍵、非極性共價鍵 .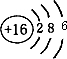 .
.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該反應中Cl2發生還原反應 | |
| B. | 根據該反應可判斷還原性:S2O32->Cl- | |
| C. | 脫氯反應后,溶液的酸性增強 | |
| D. | SO2與氯氣的漂白原理相同,所以也可以用SO2作紡織工業的漂白劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 酸性:H2CO3>HNO3 | B. | 堿性:NaOH>KOH | ||
| C. | 非金屬性:Si>P | D. | 氣態氫化物穩定性:H2O>H2S |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 含有共價鍵的化合物一定是共價化合物 | |
| B. | 單質中一定存在共價鍵 | |
| C. | 共價化合物中一定存在共價鍵 | |
| D. | 離子化合物中只含有離子鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
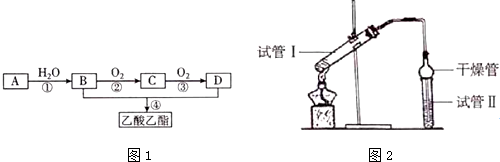
| 實驗編號 | 試管I中試劑 | 試管Ⅱ中有機層的厚度/cm |
| A | 3mL乙醇、2mL乙酸、2mL 18mol•L-1濃硫酸 | 3.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 |
| C | 3mL 乙醇、2mL 乙酸 2mL3mol•L-1H2SO4 | 0.6 |
| D | 3mL乙醇、2mL乙酸、鹽酸 | 0.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 每生成0.3molH2,被還原的水分子數目為0.6NA | |
| B. | 當有2.7gAl參加反應時,轉移的電子數目為0.3NA | |
| C. | 每生成6.72L的H2,溶液中AlO2-的數目就增加0.2NA | |
| D. | 溶液中每增加0.1mol的AlO2-,Na+的數目就增加0.1NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com