
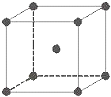
 金屬鐵晶體為體心立方堆積(如圖),實驗測得鐵的密度為ρ(g•cm-3).已知鐵的相對原子質量為a,阿伏加德羅常數為NA(mol-1).
金屬鐵晶體為體心立方堆積(如圖),實驗測得鐵的密度為ρ(g•cm-3).已知鐵的相對原子質量為a,阿伏加德羅常數為NA(mol-1).分析 (1)鐵原子的半徑為rcm,則晶胞體積對角線長度為4r cm,可知晶胞棱長為$\frac{4\sqrt{3}}{3}$r cm,利用均攤法計算晶胞中Fe原子數目,表示出晶胞質量,再根據m=ρV列式計算;
(2)空間利用率=$\frac{晶胞中Fe原子總體積}{晶胞體積}$×100%;
(3)鐵元素的原子序數是26,根據能量最低原理書寫其基態原子的電子排布式,金屬性越強,第一電離能越小;
(4)金屬Fe為體心立方密堆積,Fe原子配位數為8;
(5)①物質并不都是由原子構成的;
②金屬晶體的構成微粒為金屬陽離子與自由電子;
③原子晶體中共價鍵可決定分子晶體的熔、沸點;
④離子所帶電荷越多、離子半徑越小,晶格能越大;
⑤晶胞是晶體結構的基本單元,晶體內部的微粒按一定規律作周期性重復排列;
⑥晶體盡可能采取緊密堆積方式,以使其變得比較穩定;
⑦CsCl晶體中陰、陽離子的配位數都為8;
⑧二氧化硅晶體結構單元為硅氧正四面體,Si原子形成4個Si-O鍵中硅原子.
解答 解:(1)鐵原子的半徑為rcm,則晶胞體積對角線長度為4r cm,可知晶胞棱長為$\frac{4\sqrt{3}}{3}$r cm,晶胞中Fe原子數目為1+8×$\frac{1}{8}$=2,鐵的相對原子質量為a,晶胞質量為2×$\frac{a}{{N}_{A}}$g,鐵的密度為ρ(g•cm-3),則:ρ(g•cm-3)×($\frac{4\sqrt{3}}{3}$r cm)3=2×$\frac{a}{{N}_{A}}$g,故r=$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{2a}{ρ{N}_{A}}}$,
故答案為:$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{2a}{ρ{N}_{A}}}$;
(2)晶胞中Fe原子總體積為2×$\frac{4}{3}$π(rcm)3,晶胞體積為($\frac{4\sqrt{3}}{3}$r cm)3,則空間利用率=$\frac{2×\frac{4}{3}π{r}^{3}}{(\frac{4\sqrt{3}}{3}r)^{3}}$×100%=68%,
故答案為:68%;
(3)鐵元素的原子序數是26,基態原子的電子排布式為1s22s22p63s23p63d64s2,其同周期第ⅠA族元素基態原子的第一電離能比同周期其它基態原子的第一電離能(稀有氣體原子除外)小,
故答案為:1s22s22p63s23p63d64s2;小;
(4)金屬Fe為體心立方密堆積,體心Fe原子與頂點8個Fe原子相鄰.Fe原子配位數為8,
故答案為:8;
(5)①構成物質的微粒中,晶體中微粒呈周期性有序排列,有自范性,非晶體中微粒排列相對無序,無自范性,但物質不能都是由原子構成的,故錯誤;
②金屬晶體的構成微粒為金屬陽離子與自由電子,含有金屬陽離子的晶體不一定是離子晶體,故錯誤;
③原子晶體中共價鍵可決定分子晶體的熔、沸點,故正確;
④離子所帶電荷越多、離子半徑越小,晶格能越大,MgO的晶格能遠比NaCl大,這是因為前者離子所帶的電荷數多,離子半徑小,故正確;
⑤晶胞是晶體結構的基本單元,晶體內部的微粒按一定規律作周期性重復排列,故正確;
⑥晶體盡可能采取緊密堆積方式,以使其變得比較穩定,故正確;
⑦干冰晶體中,一個CO2分子周圍有12個CO2分子緊鄰,NaCl晶體中陰、陽離子的配位數都為6,但CsCl晶體中陰、陽離子的配位數都為8,故錯誤;
⑧二氧化硅晶體結構單元為硅氧正四面體,Si原子形成4個Si-O鍵中硅原子,硅原子采用的是sp3雜化,故正確,
故選:①②⑦.
點評 本題是對物質結構與性質的考查,涉及晶胞結構與計算、核外電子排布、晶體與非晶體、晶體類型與性質等,理解掌握均攤法進行晶胞有關計算,識記中學常見晶胞結構.


科目:高中化學 來源: 題型:選擇題
| A. | 青石棉是一種易燃品且易溶于水 | |
| B. | 青石棉的化學組成用氧化物的形式可表示為:Na2O•FeO•2Fe2O3•8SiO2•H2O | |
| C. | 1 mol Na2Fe5Si8O22(OH)2與足量的硝酸作用,至少需消耗6 L 3 mol•L-1 HNO3溶液 | |
| D. | 1 mol Na2Fe5Si8O22(OH)2與足量氫氟酸作用,至少需消耗5.5 L 2 mol•L-1HF溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向硝酸鈉溶液中滴加稀鹽酸得到的pH=5的混合溶液:c(Na+)═c(NO3-) | |
| B. | 0.1mol/L某二元弱酸強堿鹽NaHA溶液中:c(Na+)═2c(A2-)+c(HA-)+c(H2A) | |
| C. | 10mL0.5mol/L CH3COONa溶液與6mL1mol/L鹽酸混合c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| D. | 常溫下,0.1mol/L pH=4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 都具有脫水性 | |
| B. | 在加熱條件下都能與碳反應 | |
| C. | 露置于空氣中都能形成白霧 | |
| D. | 在空氣中長期露置,溶液質量均減輕 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com