
| 溶質 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 在相同溫度下,同濃度的三種酸溶液的導電能力順序:H2CO3<HClO<HF | |
| B. | 若將CO2通入0.1 mol•L-1 Na2CO3溶液中至溶液呈中性,則溶液中:2c(CO32-)+c(HCO3-)=0.1 mol•L-1 | |
| C. | 向上述NaClO溶液中通HF氣體至恰好完全反應時:c(Na+)>c(F-)>c(H+)>c(HClO)>c(OH-) | |
| D. | 根據上表水解方程式ClO-+H2O?HClO+OH-的平衡常數K≈10-7.6 |
分析 相同濃度的鈉鹽溶液堿性越強,說明酸根離子水解程度越大,則相應酸的酸性越弱,酸的電離平衡常數越小,根據鈉鹽溶液的pH知,酸根離子水解程度CO32->ClO->F-,酸的電離平衡常數從小到大順序是:HCO3-<HClO<HF,以此解答該題.
解答 解:相同濃度的鈉鹽溶液堿性越強,說明酸根離子水解程度越大,則相應酸的酸性越弱,酸的電離平衡常數越小,根據鈉鹽溶液的pH知,酸根離子水解程度CO32->ClO->F-,酸的電離平衡常數從小到大順序是:HCO3-<HClO<HF,
A.酸的電離平衡常數從小到大順序是:HCO3-<HClO<HF,在相同溫度下,同濃度的三種酸溶液的導電能力順序:HCO3-<HClO<HF,故A錯誤;
B.溶液存在電荷守恒c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),溶液呈中性,則c(H+)=c(OH-),所以c(Na+)=c(HCO3-)+2c(CO32-)=0.2mol/L,故B錯誤;
C.反應后生成HClO,由于電離程度較弱,則c(HClO)>c(H+),故C錯誤;
D.式ClO-+H2O?HClO+OH-的平衡常數為K=$\frac{c(HClO)×c(O{H}^{-})}{c(Cl{O}^{-})}$=$\frac{1{0}^{-4.3}×1{0}^{-4.3}}{0.1}$=10-7.6,故D正確;
故選D.
點評 本題考查較為綜合,涉及弱電解質的電離和鹽類的水解,為高頻考點,注意從電荷守恒的角度解答,難度不大.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 1mol氯化氫和22.4升氮氣 | |
| B. | 2molCO2和3molH2 | |
| C. | 在標準狀況下16gO2和16gCH4 | |
| D. | 同溫同壓下,0.5mol氨氣和14克CO氣體 |
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江蘇省徐州市高一上第一次月考化學卷(解析版) 題型:選擇題
下列化學用語正確的是
A.乙酸的結構簡式:C2H4O2
B.氮氣的結構式: N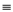 N
N
C.硫化氫的電子式: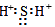
D.氯原子的結構示意圖: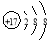
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③④ | B. | ②⑤⑥ | C. | ③⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鈰(Ce)元素在自然界中主要以化合態形式存在 | |
| B. | 鈰溶于氫碘酸的化學方程式可表示為:Ce+4HI═CeI4+2H2↑ | |
| C. | 用Ce(SO4)2溶液滴定硫酸亞鐵溶液,其離子方程式為:Ce4++Fe2+═Ce3++Fe3+ | |
| D. | 四種穩定的核素58136Ce、58138Ce、58140Ce、58142Ce,它們互稱為同位素 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 合成纖維和光導纖維都是新型無機非金屬材料 | |
| B. | 明礬凈水原理是吸附,不涉及化學變化 | |
| C. | SO2與FeSO4溶液使酸性高錳酸鉀的紫色褪去原理相同 | |
| D. | 坩堝主要用于給固體加熱,可用坩堝將燒堿加熱融化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 需要加熱才能發生的反應一定是吸熱反應 | |
| B. | 熱化學方程式中的化學計量數只表示物質的量,可以是分數 | |
| C. | 1 mol H2SO4與1 mol Ba(OH)2反應放出的熱叫做中和熱 | |
| D. | 1 mol H2與0.5 mol O2反應放出的熱就是H2的標準燃燒熱 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com