
①酸的濃度和體積;②堿的濃度和體積;③比熱容:④反應后溶液的質量;⑤生成水的物質的量;⑥反應前后溫度變化;⑦操作所需的時間。
A. ③④⑤⑥ B. ①③④⑤ C. ①②③⑥ D. 全部
科目:高中化學 來源:2016-2017學年湖南省高二上10月月考化學卷(解析版) 題型:填空題
Ⅰ.二甲醚是一種重要的清潔燃料,可以通過CH3OH分子間脫水制得:2CH3OH(g)  CH3O
CH3O CH3(g) + H2O(g) ΔH=-23.5kJ·mol-1。在t1℃,恒容密閉容器中建立上述平衡,體系中各組分濃度隨時間變化如圖所示。
CH3(g) + H2O(g) ΔH=-23.5kJ·mol-1。在t1℃,恒容密閉容器中建立上述平衡,體系中各組分濃度隨時間變化如圖所示。

(1)該條件下反應平衡常數表達式K=______________;在t1 ℃時,反應的平衡常數為____________,達到平衡時n(CH3OCH3):n(CH3OH):n(H2O)=_____________________。
(2)相同條件下,若改變起始濃度,某時刻各組分濃度依次為:c(CH3OH)=0.4 mol·L-1、c(H2O)=0.6 mol·L-1、c(CH3OCH3)=2.4mol·L-1,此時正、逆反應速率的大小:v正________v逆(填“>”、“<”或“=”),反應向__________反應方向進行(填“正”或“逆”).。
Ⅱ.已 知可逆反應:M(g)+N(g)
知可逆反應:M(g)+N(g)  P(g)+Q(g) ΔH>0,請回答下列問題:
P(g)+Q(g) ΔH>0,請回答下列問題:
(1)在某溫度下,反應物的起始濃度分別為c(M)=1 mol·L-1,c(N)=2.4 mol·L-1。達到平衡后,M的轉化率為60%,此時N的轉化率為____________。
(2)若反應溫度升高,M的轉化率__________(填“增大”、“減小”或“不變”)。
(3)若反應溫度不變,反應物的起始濃度分別為c(M)=4 mol·L-1,c(N)=a mol·L-1;達到平衡后,c(P)=2 mol·L-1,a=____________。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年甘肅省高二上月考一化學試卷(解析版) 題型:填空題
(1)常溫常壓下,依據事實,寫出下列反應的熱化學方程式。
①在25℃、101kPa下,2g甲醇燃燒生成CO2和液態水時放熱45kJ。則表示甲醇燃燒熱 的熱化學方程式為______________________。
的熱化學方程式為______________________。
②若適量的N2和O2完全反應,每生成23g NO2需要吸收17kJ熱量__________________。
(2)斷裂1mol(理想)氣體分子化學鍵所吸收的能量或形成1mol(理想)氣體分子化學鍵所放出的能量稱為鍵能(單位為KJ.mol-1)下表是一些鍵能數據(KJ·mol-1)
化學鍵 | 鍵能 | 化學鍵 | 鍵能 | 化學鍵 | 鍵能 | 化學鍵 | 鍵能 |
C—H | 414 | C—F | 489 | H—F | 565 | F—F | 158 |
H-H | 436 | H-N | 391 |
①根據鍵能數據計算以下反應的反應熱△H:
CH4(g)+4F2(g)﹦CF4(g)+4HF(g) △H
②根據鍵能和反應熱化學方程式1/2N2(g)+3/2H2(g) =NH3(g ) △H = —46 kJ·mol -1 計算N≡N的鍵能。
-1 計算N≡N的鍵能。
(3)火箭推進器中盛有強還原劑液態肼(N2H4)和強氧化劑液態雙氧水。當把0.4mol液態肼和0.8mol H2O2混合反應,生成氮氣和水蒸氣,放出256kJ的熱量(25℃、101 kPa下測得的熱量)。
①該反應的熱化學方程式為 。
②又已知H2O(l) =H2O(g) ΔH=+44kJ/mol。則16g液態肼與液態雙氧水反應生成液態水時放出的熱量是 kJ。
=H2O(g) ΔH=+44kJ/mol。則16g液態肼與液態雙氧水反應生成液態水時放出的熱量是 kJ。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年安徽省高二上月考一化學試卷(解析版) 題型:填空題
氮、磷及其化合物在生產、生活中有重要的用途。回答下列問題:
(1)在堿性條件下,次磷酸鹽可用于化學鍍銀,完成其反應的離子方程式:
口H2PO2-+口Ag++口________=口PO43-+口Ag+口________
(2)由工業白磷(含少量砷、鐵、鎂等)制備高純白磷(熔點44℃,沸點280℃),主要生產流程如下:
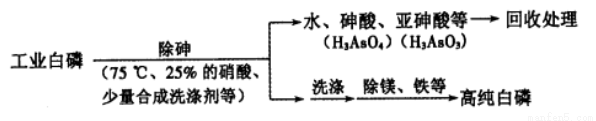
①關于除砷條件的說法合理的是__________(填字母)。
a.75℃使白磷熔化,并溶于水 b.硝酸濃度不易過大,防止白磷反應
c.溫度不易過高,防止硝酸分解 d.適當提高溫度,加快化學反應速率
②硝酸氧化除砷時被還原為NO,氧化相同質量的砷.當轉化為亞砷酸的量越多,消耗硝酸的量越 _____________(填“多”或“少”)。
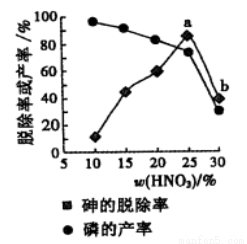
③某條件下,用一定量的硝酸處理一定量的工業白磷,砷的脫除率及磷的產率隨硝酸質量分數的變化如右圖,砷的脫除率從a點到b點降低的原因是_____________。
(3)某溫度下,已知:
Ag+(aq)+2NH3(aq)  Ag(NH3)2+(aq) k1=1.10×107
Ag(NH3)2+(aq) k1=1.10×107
AgCl(s) Ag+(aq)+Cl-(aq) K2=1.45×10-10
Ag+(aq)+Cl-(aq) K2=1.45×10-10
①反應平衡常數的表達式K1=______________。
②計算可逆反應AgCl(s)+2NH3(aq) Ag(NH3)2+(aq)+Cl-(aq)的化學平衡常數K=___________(保留2位有效數字)。
Ag(NH3)2+(aq)+Cl-(aq)的化學平衡常數K=___________(保留2位有效數字)。
③1Llmol/L氨水中最多可以溶解AgCl__________mol(保留1位有效數字,忽略溶液體積變化)。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年安徽省高二上月考一化學試卷(解析版) 題型:選擇題
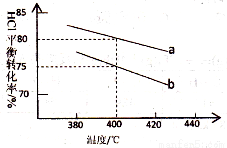
對于反應:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g),下圖是兩種投料比[n(HCl):(O2)分別為4:1和2:1]下,反應溫度對HCl平衡轉化率影響的曲線。則投料比為4:1、溺度為400℃時,平衡混合物中Cl2的體積分數是( )
2Cl2(g)+2H2O(g),下圖是兩種投料比[n(HCl):(O2)分別為4:1和2:1]下,反應溫度對HCl平衡轉化率影響的曲線。則投料比為4:1、溺度為400℃時,平衡混合物中Cl2的體積分數是( )
A. B.
B.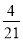 C.
C.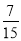 D.
D.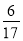
查看答案和解析>>
科目:高中化學 來源:2016-2017學年安徽省高二上月考一化學試卷(解析版) 題型:選擇題
下列情況下,反應速率相同的是( )
A.等體積0.1mol/L H2SO4和0.2 mol/L HNO3分別與等質量銅片反應
B.等質量的鋅粒和鋅粉分別與等體積1 mol/L H2SO4反應
C.等體積0.2 mol/L HCl和0.1 mol/L H2SO4分別與等質量相同形狀石灰石反應
D.等體積0.1 mol/L HCl和0.1mol/L HNO3分別與等質量Al2O3粉末反應
查看答案和解析>>
科目:高中化學 來源:2017屆重慶市高三上9月月考化學試卷(解析版) 題型:填空題
氫能的存儲是氫能應用的主要瓶頸,配位氫化物、富氫載體化合物是目前所采用的主要儲氫材料。
(1)Ti(BH4)2是一種過渡元素硼氫化物儲氫材料。基態Ti原子電子占據的最高能層符號________,基態Ti2+的價電子的電子排布式 。
(2)液氨是富氫物質,是氫能的理想載體,利用N2+3H2?2NH3實現儲氫和輸氫.下列說法正確的是_________(填序號);
a.NH3分子中氮原子的軌道雜化方式為sp2雜化
b.NH4+與C1O4-、PH4+、CH4、BH4-互為等電子體
c.相同壓強時,NH3的沸點比PH3的沸點高
d.電負性C<N<O , 第一電離能C< O < N
(3)Se與O同族,則 SeO2分子的空間構型為
(4)富勒 烯(C60)的結構如圖甲,分子中碳原子軌道的雜化類型為 ;1mol C60分子中σ鍵的數目為 個.
烯(C60)的結構如圖甲,分子中碳原子軌道的雜化類型為 ;1mol C60分子中σ鍵的數目為 個.
(5)圖乙為一個金屬銅的晶胞,此晶胞立方體的邊長為a pm,Cu的相對原子質量為64,金屬銅的密度為ρ g/cm3,則阿伏加德羅常數可表示為 mol﹣1(用含a、ρ的代數式表示).

查看答案和解析>>
科目:高中化學 來源:2017屆重慶市高三上9月月考化學試卷(解析版) 題型:選擇題
設NA代表阿伏伽德羅常數的值,下列敘述正確的是( )
A.標準狀況下,18gH218O所含質子數為10NA
B.1 mol乙醇中含有極性鍵的 數目為8NA
數目為8NA
C.1mol的﹣NH2與1molNH4+所含電子數均為10NA
D.1 mol Na2O和Na2O2混合物中含有的陰、陽離子總數是3NA
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山西省高二上10月月考化學卷(解析版) 題型:實驗題
測定中和反應的反應熱的實驗步驟如下:
①用量筒量取50ml0.25mol/L硫酸倒入小燒杯中,測出硫酸溶液溫度
②用另一量筒量取50ml0.55mol/LNaOH溶液,并測出其溫度
③將NaOH溶液倒入小燒杯中,設法使之混合均勻,測出混合液最高溫度
回答下列問題:
(1)倒入NaOH溶液的正確操作是 。
A.沿玻璃棒緩慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸與NaOH溶液混合均勻的正確操作是 。
A.用溫度計小心攪拌 B.揭開硬紙片用玻璃棒攪拌
C.輕輕地振蕩燒杯 D.用套在溫度計上的環形玻璃棒輕輕地攪動
(3)實驗數據如下表:
溫度 溶液 試驗次數 | 起始溫度t1℃ | 終止溫度t2/℃ | 溫度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | |
2 | 25.9 | 25.9 | 25.9 | 29.2 | |
3 | 26.4 | 26.2 | 26.3 | 29.8 | |
近似認為0.55mol/LNaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3,中和后混合溶液的比熱容c=4.18J/(g·℃)。利用上表數據計算該中和反應的反應熱△H= (保留一位小數);寫出上述中和熱的熱化學方程式 。
②利用上表數據計算出的中和熱與57.3kJ/mol有偏差,產生偏差的原因可能是(填字母) 。
a.實驗裝置保溫、隔熱效果差
b.用溫度計測定NaOH溶液起始溫度后直接測定H2SO4溶液的溫度
c.量取NaOH溶液的體積時仰視讀數
d.分多次把NaOH溶液倒入盛有硫酸的小燒杯中
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com