已知A、B、C、D、M、W六種元素的原子序數(shù)依次遞增,都位于前四周期.其中A、D原子的最外層電子數(shù)均等于其周期序數(shù),且D原子的電子層數(shù)是A的3倍;B原子核外電子有6種不同的運動狀態(tài),且S軌道電子數(shù)是P軌道電子數(shù)的兩倍;C原子L層上有2對成對電子.M和W均有“生物金屬”之稱,M
4+離子和氬原子的核外電子排布相同;W處于周期表中第8列.請回答下列問題:
(1)1mol B
2A
2分子中含σ鍵的數(shù)目是
.
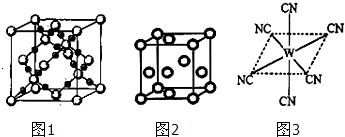
(2)BC
2在高溫高壓下所形成的晶體其晶胞(晶體中最基本的重復(fù)單元)如圖1所示.則該晶體的類型屬于
晶體(選填“分子”、“原子”、“離子”或“金屬”);該晶體中B原子軌道的雜化類型為
.
(3)“生物金屬”M內(nèi)部原子的堆積方式與銅相同,都是面心立方堆積方式,如圖2.則晶胞中M原子的配位數(shù)為
;若該晶胞的密度為ρ g/cm
3,阿伏加德羅常數(shù)為N
A,M原子的摩爾質(zhì)量為Mr g/mol,則該晶胞的“邊長”為
cm.
(4)“生物金屬”W元素應(yīng)用廣泛,如人體內(nèi)W元素的含量偏低,則會影響O
2在體內(nèi)的正常運輸.已知W
2+與KCN溶液反應(yīng)得W(CN)
2沉淀,當加入過量KCN溶液時沉淀溶解,生成配合物,其配離子結(jié)構(gòu)如圖3所示.
①W元素基態(tài)原子價電子排布式為
.
②已知CN-與
(一種分子)互為等電子體,則1個CN-中π鍵數(shù)目為
.
(5)光譜證實單質(zhì)D與強堿溶液反應(yīng)有[D(OH)
4]
-生成,則[D(OH)
4]
-中存在
.
a.共價鍵 b.配位鍵 c.σ鍵 d.π鍵.




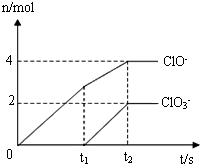 在一定量的石灰乳中通入一定量的氯氣,二者恰好完全反應(yīng)(發(fā)生反應(yīng)的反應(yīng)均為放熱反應(yīng)).生成物中有三種含氯元素的離子,其中兩種離子的物質(zhì)的量(n)與反應(yīng)時間(t)的曲線如圖所示.已知,生成ClO3-離子的反應(yīng)為:6Ca(OH)2+6Cl2=5CaCl2+Ca(ClO3)2+6H2O.
在一定量的石灰乳中通入一定量的氯氣,二者恰好完全反應(yīng)(發(fā)生反應(yīng)的反應(yīng)均為放熱反應(yīng)).生成物中有三種含氯元素的離子,其中兩種離子的物質(zhì)的量(n)與反應(yīng)時間(t)的曲線如圖所示.已知,生成ClO3-離子的反應(yīng)為:6Ca(OH)2+6Cl2=5CaCl2+Ca(ClO3)2+6H2O. (1)25°C時,NaOH和Na2CO3兩溶液的pH均為11.
(1)25°C時,NaOH和Na2CO3兩溶液的pH均為11.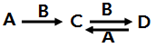 短周期主族元素X、Y、Z、W、M、N 的原子序數(shù)依次增大,且原子最外層電子數(shù)之和為23.X的原子半徑比Y的小,X與W同主族,Z的最外層電子數(shù)是電子層數(shù)的3倍,M是地殼中含量最高的金屬元素.
短周期主族元素X、Y、Z、W、M、N 的原子序數(shù)依次增大,且原子最外層電子數(shù)之和為23.X的原子半徑比Y的小,X與W同主族,Z的最外層電子數(shù)是電子層數(shù)的3倍,M是地殼中含量最高的金屬元素.