
分析 本題是利用甲醇與濃鹽酸反應制備CH3Cl,涉及具體的制備過程是先在干燥的HCl氣流中加熱ZnCl2晶體得到無水ZnCl2,再將無水ZnCl2和量取20mL濃鹽酸放入圓底燒瓶并滴加一定量的甲醇,經加熱后會有CH3Cl生成,因CH3Cl中混有揮發出的HCl及甲醇,選擇排水法收集生成的氣體的同時還可以除雜,另外還探究了的穩定性及含有CH3Cl尾氣的處理;
(1)①因ZnCl2晶體直接加熱時,因Zn2+水解,如果直接加熱最終得到的是Zn(OH)2,因此要用濃鹽酸或HCl氣體抑制其水解的同時加熱;
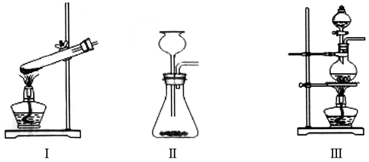
②該實驗為固液加熱型,且反應物易揮發,故選Ⅲ;
③因反應混合物中的鹽酸和甲醇均易揮發,生成的CH3Cl中會混有揮發出的雜質,同時CH3Cl難溶于水,選用排水法收集的同時還會有除雜的作用;
(2)①如果CH3Cl能被酸性高錳酸鉀氧化,則酸性高錳酸鉀溶液本身會褪色,同時可能會生成CO2和Cl2,因此要注意尾氣的處理;
②因CH3Cl易溶于乙醇和丙醇等有機溶劑,因此的尾氣可選擇有機溶劑吸收.
解答 解:(1)①在加熱ZnCl2晶體時可選擇通HCl氣體抑制其水解;
故答案為:在干燥的HCl氣流中加熱;
②該實驗為固液加熱型,且反應物易揮發,故選Ⅲ;
故答案為:Ⅲ;
③因CH3Cl中混有易溶于水的雜質氣體,用排水法可以即除雜又可收集,故答案為:CH3Cl不易溶于水,用排水法可除去HCl、CH3OH等雜質氣體;
故答案為:排水法;CH3Cl難溶于水,用排水法收集同時可除去HCl、CH3OH等雜質氣體;
(2)①如果CH3Cl能被強氧化劑酸性高錳酸鉀氧化,可選擇先通過盛有水的洗氣瓶除去可能混合有的HCl和甲醇,再通過盛有的酸性高錳酸鉀洗氣瓶,溶液的紫色會褐去,最后通過盛Na2SO3的洗氣瓶吸收生成的氯氣防污染,CH3Cl與酸性高錳酸鉀的反應為:10CH3Cl+14MnO4-+42H+═14Mn2++10CO2↑+5Cl2↑+36H2O;
故答案為:BAC; KMnO4溶液紫色褪去;10CH3Cl+14MnO4-+42H+═14Mn2++10CO2↑+5Cl2↑+36H2O;
②CH3Cl易溶于乙醇和丙醇等有機溶劑,可選擇酒精吸收CH3Cl的尾氣;
故答案為:乙醇(或其它有機溶劑).
點評 本題考查了物質的制備,涉及實驗操作、鹽類水解、物質的性質檢驗及反應原理的探究,綜合性較強,但基礎性知識偏多,難度不大,離子方程式的書寫錯誤率可能偏高點.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | 每種烴的含氧衍生物中至少有3種元素 | |
| B. | 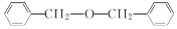 中含有的官能團為醚基 中含有的官能團為醚基 | |
| C. | 所有的有機物中都含有碳,多數含氫,其次還含有氧、氮、鹵素、硫、磷等 | |
| D. | 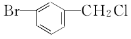 屬于芳香鹵代烴 屬于芳香鹵代烴 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
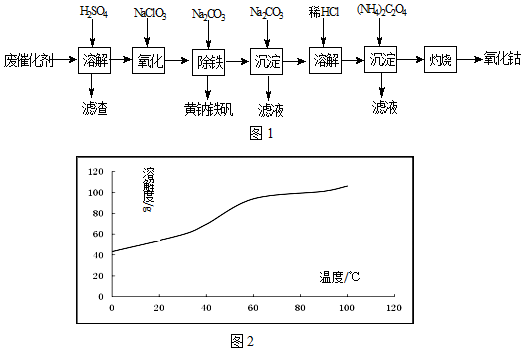
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
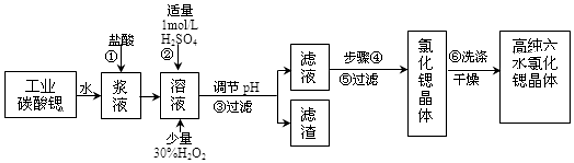
| 氫氧化物 | Fe(OH)3 | Fe(OH)2 |
| 開始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
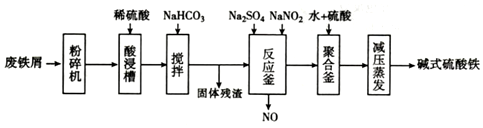
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 開始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 欲檢驗某溶液中含有Fe2+,先向該溶液中加氯水,再加硫氰化鉀 | |
| B. | 常溫下,鋁罐可以用于盛裝濃硝酸,利用了濃硝酸的酸性 | |
| C. | Na2O2與水反應可用于制O2,其中Na2O2既做氧化劑又做還原劑 | |
| D. | 可用HF刻蝕玻璃,是因為玻璃中含有的SiO2具有酸性氧化物的通性 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
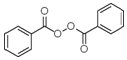 也被禁用. 下面是一種以苯為原料合成過氧化苯甲酰的流程:
也被禁用. 下面是一種以苯為原料合成過氧化苯甲酰的流程: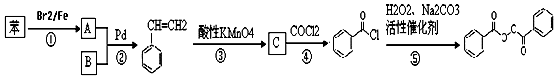
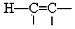 $\stackrel{Pd}{→}$
$\stackrel{Pd}{→}$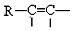
 ;
;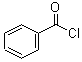 +H2O2$\frac{\underline{\;催化劑\;}}{碳酸鈉}$
+H2O2$\frac{\underline{\;催化劑\;}}{碳酸鈉}$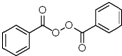 +2HCl;
+2HCl;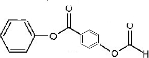 、
、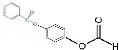 ;
; ;
; 的流程,無機物任選,注明反應條件.
的流程,無機物任選,注明反應條件.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
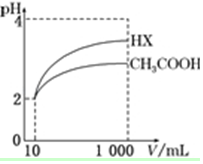 25℃時,部分物質的電離常數如表所示:
25℃時,部分物質的電離常數如表所示:| 化學式 | CH3COOH | H2CO3 | HClO |
| 電離常數 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③④⑤⑦ | B. | ①②③④⑤⑦ | C. | ①②③④⑥ | D. | ①④⑥⑦ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com