
| 氫氧化物 | Fe(OH)3 | Fe(OH)2 |
| 開始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
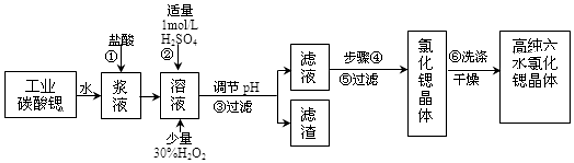
分析 以SrCO3為原料制備六水氯化鍶(SrCl2•6H2O),由流程可知,SrCO3和鹽酸反應后溶液中除含有Sr2+和Cl-外,還含有少量Fe2+、Ba2+雜質,然后加硫酸生成硫酸鋇沉淀,加入過氧化氫,調節溶液pH可生成氫氧化鐵沉淀,所以過濾后濾渣為硫酸鋇和氫氧化鐵,濾液中含SrCl2,最后蒸發、冷卻結晶得到SrCl2•6H2O,以此來解答.
解答 解:(1)步驟②中加入少量的30%H2O2的目的是將Fe2+氧化成Fe3+,反應的離子方程式為 2Fe2++H2O2+2H+=2Fe3++2H2O;
故答案為:2Fe2++H2O2+2H+=2Fe3++2H2O;
(2)調節溶液的pH目的是使鐵離子沉淀;調節溶液的pH的同時不能引入其他雜質,所以選擇SrO、SrCO3或Sr(OH)2等;因為碳酸鍶固體中還含有少量鋇的化合物,所以操作③中所得濾渣的主要成分是Fe(OH)3、BaSO4;
故答案為:SrO、SrCO3或Sr(OH)2等; Fe(OH)3和BaSO4 ;
(3)步驟④包括蒸發濃縮、冷卻結晶,為防止溫度過高使用SrCl2•6H2O 晶體失水,因此采用 60℃的熱水浴加熱蒸發到溶液表面出現晶膜,然后冷卻結晶,A正確;結晶速率越慢,得到的晶體顆粒越大,采用降低結晶速率的方法來得到較大顆粒的SrCl2•6H2O 晶體,B正確; 只有溶液達到過飽和后仍無晶體析出,才可用玻璃棒攪動或輕輕摩擦容器壁的方法使晶體析出,C錯誤;步驟④是冷卻結晶,因此步驟⑤是常溫過濾或減壓過濾,步驟⑥后得到高純SrCl2•6H2O 晶體,所以選擇的無機洗滌劑為飽和氯化鍶溶液,減小晶體的溶解同時也不會產生其他雜質,D錯誤;
故答案為:A、B;
(4)SrCl2•6H2O 晶體在61℃時開始失去結晶水,故工業上采用減壓烘干或者用50~60℃的熱風吹干SrCl2•6H2O晶體;
故答案為:防止SrCl2•6H2O 晶體在61℃以上時失去結晶水;
(5)根據關系式NH4SCN~AgNO3可知,過量的AgNO3的質量為0.2 mol/L×0.02 L×170g/mol=0.68g,則根據:SrCl2•6H2O~2AgNO3
267 2×170
樣品中SrCl2•6H2O的質量為:$\frac{267×(2.38-0.68)}{2×170}$=1.335g,則原SrCl2•6H2O晶體的純度為$\frac{1.335g}{1.4g}×100%$=95.3%;
故答案為:95.3%.
點評 本題考查制備實驗方案的設計,為高頻考點,把握制備流程中發生的化學反應及物質分離方法為解答的關鍵,涉及反應速率、氧化還原反應、滴定原理、滴定實驗的數據計算應用等,注意信息與所學知識的綜合應用,綜合性較強,題目難度中等.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 200 mL 0.5mol/LNaCl溶液 | B. | 50 mL 0.3mol/LNa2SO4溶液 | ||
| C. | 150 mL 0.4mol/LNaOH | D. | 200mL0.15mol/LNa3PO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 體積相等時密度之比為2:1 | |
| B. | 原子數相等時具有的電子數之比為1:4 | |
| C. | 質量相等時具有的質子數之比為4:5 | |
| D. | 體積相等時具有的原子數之比為1:2 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 原因 | 結論 |
| A | 乙烯和苯都能使溴水褪色 | 苯分子和乙烯分子含有相同的碳碳雙鍵 |
| B | 乙酸分子中含有羧基 | 可與NaHCO3溶液反應生成CO2 |
| C | 纖維素和淀粉的化學式均為(C6H10O5)n | 它們屬于同分異構體 |
| D | 乙酸乙酯和乙烯在一定條件下都能與水反應 | 二者屬于同一反應類型 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用酒精萃取碘水中的碘 | |
| B. | 用蒸餾法進行海水淡化 | |
| C. | 用過濾的方法除去NaCl溶液中含有的少量淀粉膠體 | |
| D. | 用加熱-蒸發的方法可以除去粗鹽中的CaCl2、MgCl2等雜質 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com