
 .
.分析 (1)舊鍵斷裂吸收的能量減去新鍵生成釋放的能量值即為反應熱,1molN2含有1molN≡N,1molH2含有1molH-H,1molNH3含有3molN-H,依據△H=反應物的總鍵能-生成物的總鍵能進行計算;NaCN為離子化合物,由Na+和CN-構成,電子式為:Na+ ;
;
(2)氰化鈉溶液的CN-被雙氧水氧化為HCO3-,同時放出NH3,據此書寫反應的離子方程式;氰化鈉中毒,可用Na2S2O3緩解,二者反應得到兩種含硫元素的離子,其中一種遇到Fe3+可變為血紅色,即反應生成SCN-、SO32-;
(3)NaCN是強堿弱酸鹽水解溶液呈強堿性,則溶液中各離子濃度由大到小的順序為c(Na+)>c(CN-)>c(OH-)>c(H+);向等體積pH=10的NaOH溶液和NaCN溶液溶液中氫氧根離子濃度相等,在加鹽酸的過程中NaCN繼續水解產生氫氧根離子會消耗更多的鹽酸;
(4)元素Z與Na處于同一周期,在本周期主族元素形成的簡單離子中,Z的離子半徑最小,Z為鋁元素,處于元素周期表中第三周期ⅢA族;比較Al和Mg金屬性強弱的方法中,
a.金屬性強弱與兩種元素單質的硬度和熔、沸點無關;
b.測等濃度相應氯化物水溶液的pH,pH越小金屬性越弱;
c.金屬性越強,單質與同濃度鹽酸反應的劇烈程度就越大;
d.金屬性強弱與化合價高低無關(即與失去電子數多少),與難易程度有關.
解答 解:(1)已知:H-H鍵能為436kJ/mol,N-H鍵鍵能為391kJ/mol,令N≡N鍵的鍵能為x,對于反應N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol,
反應熱=反應物的總鍵能-生成物的總鍵能,故△H=xkJ/mol+3×436kJ/mol-2×3×391=-92kJ/mol,解得:x=946kJ/mol,NaCN為離子化合物,由Na+和CN-構成,電子式為:Na+ ;故答案為:946kJ/mol;Na+
;故答案為:946kJ/mol;Na+ ;
;
(2)氰化鈉溶液的CN-被雙氧水氧化為HCO3-,同時放出NH3,反應的離子方程式為:CN-+H2O2+H2O═NH3↑+HCO3-,氰化鈉中毒,可用Na2S2O3緩解,二者反應得到兩種含硫元素的離子,其中一種遇到Fe3+可變為血紅色,即反應生成SCN-、SO32-,離子反應為S2O32-+CN-═SCN-+SO32-,
故答案為:CN-+H2O2+H2O═NH3↑+HCO3-;S2O32-+CN-═SCN-+SO32-;
(3)NaCN是強堿弱酸鹽水解溶液呈強堿性,則溶液中各離子濃度由大到小的順序為c(Na+)>c(CN-)>c(OH-)>c(H+);向等體積pH=10的NaOH溶液和NaCN溶液溶液中氫氧根離子濃度相等,即CN-水解產生的OH-和NaOH完全電離產生的OH-相等,但水解的程度是很微弱的,隨著稀鹽酸的加入,NaOH中OH-離子被消耗逐漸減少,但NaCN中OH-被消耗后又不斷地水解產生OH-,因此會消耗更多的鹽酸,所以NaCN產生消耗的鹽酸更多,故答案為:c(Na+)>c(CN-)>c(OH-)>c(H+);大于;
(4)元素Z與Na處于同一周期,在本周期主族元素形成的簡單離子中,Z的離子半徑最小,Z為鋁元素,處于元素周期表中第三周期ⅢA族;比較Al和Mg金屬性強弱的方法中,
a.金屬性強弱與兩種元素單質的硬度和熔、沸點無關,故a錯誤;
b.測等濃度相應氯化物水溶液的pH,pH越小金屬性越弱,故b正確;
c.金屬性越強,單質與同濃度鹽酸反應的劇烈程度就越大,故c正確
d.金屬性強弱與化合價高低無關(即與失去電子數多少),與難易程度有關,故d錯誤;
故答案為:第三周期ⅢA族;bc.
點評 本題考查化學反應熱、電子式、離子方程式的書寫、離子濃度大小的比較、結構性質位置關系綜合應用、難度中等,推斷元素是解題關鍵,注意理解掌握金屬性強弱比較.


科目:高中化學 來源: 題型:選擇題
| A. | 50mL 3mol/L KCl溶液 | B. | 75 mL 2mol/L CaCl2溶液 | ||
| C. | 100 mL 0.5mol/L BaCl2溶液 | D. | 50mL 1mol/L AlCl3溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②③④⑤① | B. | ②③①④⑤ | C. | ①②③④⑤ | D. | ②①③④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
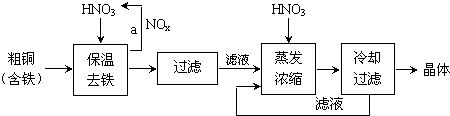
| 氫氧化物開始沉淀時的pH | 氫氧化物沉淀完全時的pH | |
| Fe3+ Cu2+ | 1.9 4.7 | 3.2 6.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
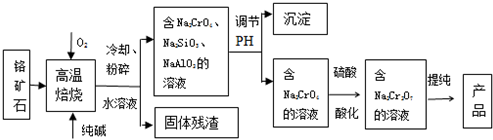
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 銅制品既能發生吸氧腐蝕又能發生析氫腐蝕 | |
| B. | 鋁制品由于表面有致密的氧化膜,可以穩定存在于空氣中 | |
| C. | 蘋果放在空氣中久置變黃和漂白過紙張久置變黃原理相似 | |
| D. | 高純度的SiO2對光有很好的折射和全反射作用,可以制成光電池將光能直接轉化為電能 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com